��Ŀ����
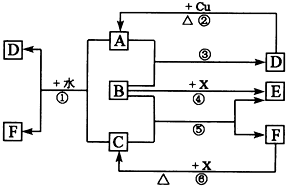 ���и�����Ϊ��ѧ��ѧ�г������ʣ�����A��C��E��FΪ���壬B��DΪ��ɫҺ�壬D��һ����Ҫ�Ļ���ԭ�ϣ�F��Ũ��Һ��X����ͨ������ʵ�����Ʊ�����C��X��һ�ֺ�ɫ��ĩ��B��������18�����ӣ�A���γ��������Ҫ���壮��Ӧ�в�������������ȥ��
���и�����Ϊ��ѧ��ѧ�г������ʣ�����A��C��E��FΪ���壬B��DΪ��ɫҺ�壬D��һ����Ҫ�Ļ���ԭ�ϣ�F��Ũ��Һ��X����ͨ������ʵ�����Ʊ�����C��X��һ�ֺ�ɫ��ĩ��B��������18�����ӣ�A���γ��������Ҫ���壮��Ӧ�в�������������ȥ���Իش��������⣺
��1��B�ĵ���ʽΪ��
��2��д����Ӧ�ڵĻ�ѧ����ʽ��
��3��д����Ӧ�����ӷ���ʽ����
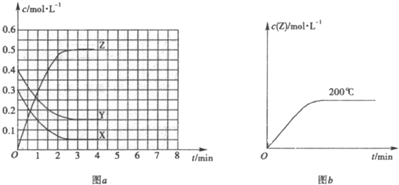
��4������ͼ����Ϣ��B��C��D��X�����Դ�ǿ������˳����
���㣺������ƶ�
ר�⣺
������X��һ�ֺ�ɫ��ĩ��B��������18�����ӣ�ʵ���ҳ���B��X�Ʊ�����E��ӦΪH2O2��MnO2�����������ɵķ�Ӧ����XΪMnO2��BΪH2O2��EΪO2��F����Һ��X����ͨ������ʵ�����Ʊ�����C��ΪMnO2��Ũ���ᷴӦ�Ʊ�Cl2�ķ�Ӧ����FΪHCl��CΪCl2��D��һ�ֲ��ӷ����ᣬ��Ũ��Һ��ǿ�����ԣ�ӦΪH2SO4������A���γ��������Ҫ���壬����H2O2��Ӧ���ɣ���AΪSO2��������ʵ����ʽ����⣮
���
�⣺X��һ�ֺ�ɫ��ĩ��B��������18�����ӣ�ʵ���ҳ���B��X�Ʊ�����E��ӦΪH2O2��MnO2�����������ɵķ�Ӧ����XΪMnO2��BΪH2O2��EΪO2��F����Һ��X����ͨ������ʵ�����Ʊ�����C��ΪMnO2��Ũ���ᷴӦ�Ʊ�Cl2�ķ�Ӧ����FΪHCl��CΪCl2��D��һ�ֲ��ӷ����ᣬ��Ũ��Һ��ǿ�����ԣ�ӦΪH2SO4������A���γ��������Ҫ���壬����H2O2��Ӧ���ɣ���AΪSO2��
��1��ͨ��������֪AΪSO2��BΪ�������Ƶ���ʽΪ��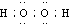 ���ʴ�Ϊ��SO2��
���ʴ�Ϊ��SO2��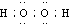 ��
��
��2����Ӧ��Ϊͭ��Ũ����ķ�Ӧ������ʽΪCu+2H2SO4��Ũ��
CuSO4+SO2��+2H2O��
�ʴ�Ϊ��Cu+2H2SO4��Ũ��
CuSO4+SO2��+2H2O��
��3����Ӧ��ΪMnO2��Ũ���ᷢ����Ӧ�Ʊ�Cl2�ķ�Ӧ����Ӧ�����ӷ���ʽΪMnO2+4H++2Cl-
Mn2++Cl2��+2H2O��
�ʴ�Ϊ��MnO2+4H++2Cl-
Mn2++Cl2��+2H2O��
��4�����������������Դ�����������������Կ��жϣ�X����C����������X��C����B��C�ķ�Ӧ��C����Ϊ�����ԣ�B����Ϊ��ԭ�ԣ���������C��B��B��A��Ӧ����D����������B��D������������X��C��B��D����MnO2��Cl2��H2O2��H2SO4��
�ʴ�Ϊ��MnO2��Cl2��H2O2��H2SO4��
��1��ͨ��������֪AΪSO2��BΪ�������Ƶ���ʽΪ��
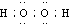 ���ʴ�Ϊ��SO2��
���ʴ�Ϊ��SO2��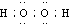 ��
����2����Ӧ��Ϊͭ��Ũ����ķ�Ӧ������ʽΪCu+2H2SO4��Ũ��
| ||
�ʴ�Ϊ��Cu+2H2SO4��Ũ��
| ||
��3����Ӧ��ΪMnO2��Ũ���ᷢ����Ӧ�Ʊ�Cl2�ķ�Ӧ����Ӧ�����ӷ���ʽΪMnO2+4H++2Cl-
| ||
�ʴ�Ϊ��MnO2+4H++2Cl-
| ||
��4�����������������Դ�����������������Կ��жϣ�X����C����������X��C����B��C�ķ�Ӧ��C����Ϊ�����ԣ�B����Ϊ��ԭ�ԣ���������C��B��B��A��Ӧ����D����������B��D������������X��C��B��D����MnO2��Cl2��H2O2��H2SO4��
�ʴ�Ϊ��MnO2��Cl2��H2O2��H2SO4��
���������⿼��������ƶϣ���Ŀ�Ѷ��еȣ�����ע��������ʵķ��ӹ����ص��Լ����͵��������ʣ�����Ϊ�ƶ����ͻ�ƿڣ�����ʱע����ᣮ

��ϰ��ϵ�д�
�����Ŀ
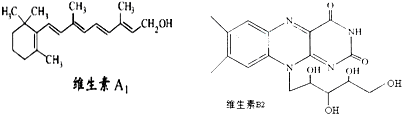
ά����A1��B2�Ľṹ��ʽ�ֱ���ͼ��ʾ����֪��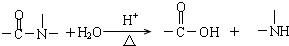 ������˵����ȷ���ǣ�������
������˵����ȷ���ǣ�������
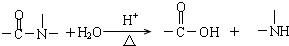 ������˵����ȷ���ǣ�������
������˵����ȷ���ǣ�������
| A��1molά����A1�������ˮ�е�4molBr2�����ӳɷ�Ӧ |
| B��ά����A1�ķ���ʽΪC19H30O����һ��������ˮ�ĸ߷��� |
| C��ά����B2�����������³���ˮ���õ����л��������ڷ��������ö����� |
| D����-C4H9ȡ��ά����B2�����ϵ�һ��Hԭ�ӣ����ɵ�4��ͬ���칹�� |
�����й�˵������ȷ���ǣ�������
| A�������£�PbSO4������pH=7��CH3COONH4��Һ��˵����CH3COO��2Pb��������� |
| B����Na2CO3��Һ�м�����BaSO4��ĩ�����ˣ���ϴ���ij����м�ϡ���ᣬ�����ݲ�������Ksp��BaCO3����Ksp��BaSO4�� |
| C��DZͧ�ϵĺ˷�Ӧ��ʹ��Һ̬��-�ƺϽ������Ƚ��ʣ����Ͻ���n��Na����n��Al��������Ͷ�뵽������ˮ�пɵ���ɫ����Һ |
| D������֧ʢ��KI3��Һ���Թ��У��ֱ�μӵ�����Һ��AgNO3��Һ��ǰ����Һ�����������л�ɫ������˵��KI3��Һ�д���ƽ�⣺I3-�TI2+I- |
���� �£�0.1mol/L��ˮ��
=1��10-10������˵����ȷ���ǣ�������
| c(H+) |
| c(OH-) |
| A����Һ����ˮ�������c��OH-��=1��10-10mol/L |
| B����Һ��c��OH-��+c��NH3?H2O��=0.1mol/L |
| C����0.1mol/L ������������Ϻ�������Һ�У�c��Cl-��=c��NH4+��+c��NH3?H2O��=0.1mol/L |
| D��ԭ��Һ�м����������Ȼ�茶�����ˮϡ�ͣ���Һ�е�c��H+�������� |
������أ�K2FeO4����һ�����͡���Ч�����ˮ�����������з�Ӧ����ȡK2FeO4��2Fe��OH��3+3Cl2+10KOH
2K2FeO4+6KCl+8H2O�������йظ÷�Ӧ˵����ȷ���ǣ�������
| ||
| A���÷�Ӧ���û���Ӧ |
| B����Ԫ�ػ��ϼ۽��� |
| C��Fe��OH��3����������Ӧ |
| D��Cl2�ǻ�ԭ�� |
��ҵ���ú�п���ϣ���FeO��CuO�����ʣ���ȡ����ZnO���������£�

����֪Ksp[Fe��OH��3]=2.6��10-39��Ksp[Cu��OH��2]=2.2��10-20��������˵������ȷ���ǣ�������

����֪Ksp[Fe��OH��3]=2.6��10-39��Ksp[Cu��OH��2]=2.2��10-20��������˵������ȷ���ǣ�������
| A�����������У�����ʱ�õ���60% H2SO4���ܶ���1.5 g/cm3����������100 mL����H2SO4��Һ������Ҫ18.4 mol?L-1��Ũ����ԼΪ49.9mL |
| B������������H2O2��ֻ��Fe��OH��3�������֣�����Һ��c��Fe3+��=2.6��10-15mol?L-1������Һ��c��Cu2+����2.2��10-4mol?L-1 |
| C��������NH4HCO3�����ɵij�����Zn5��OH��6��CO3��2����÷�ӦΪ5ZnSO4+10NH4HCO3=Zn5��OH��6��CO3��2��+5��NH4��2SO4+8CO2��+2H2O |
| D�������ɵij�������̬��ΪZna��OH��b ��CO3��c�ģ�a��b��c���������������ּ�ʽ̼��п�Ļ�����ֱ������Zn5��OH��6��CO3��2 ��Zn3��OH��6CO3 |
���ںϽ���������ٺϽ������ٺ����ֽ������ںϽ��е�Ԫ���Ի��������ʽ���ڣ��ۺϽ���һ�����������ܺϽ�һ���ǻ���������ȷ���ǣ�������
| A���٢ڢۢ� | B���٢ۢ� |
| C���ڢۢ� | D���ۢ� |