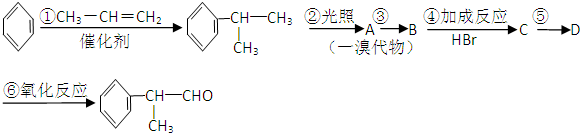
题目内容
下列离子或分子在溶液中能大量共存,但通入NO2后会发生化学反应且生成沉淀的一组是( )
| A、Ba2+、Na+、Cl-、HSO3- |
| B、NH4+、K+、ClO-、S2- |
| C、Cu2+、Fe2+、NO3-、SO42- |
| D、Ag+、Na+、NH3?H2O、SO42- |
考点:离子共存问题
专题:
分析:根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,结合通入NO2后会发生化学反应且生成沉淀来解答.
解答:
解:A.该组离子之间不反应,可大量共存,且通入NO2后会发生化学反应且生成硫酸钡沉淀,故A选;
B.ClO-、S2-发生氧化还原反应,不能大量共存,故B不选;
C.该组离子之间不反应,可大量共存,但通入NO2后会发生化学反应不生成沉淀,故C不选;
D.Ag+分别与NH3?H2O、SO42-反应,发生复分解反应,不能大量共存,故D不选;
故选A.
B.ClO-、S2-发生氧化还原反应,不能大量共存,故B不选;
C.该组离子之间不反应,可大量共存,但通入NO2后会发生化学反应不生成沉淀,故C不选;
D.Ag+分别与NH3?H2O、SO42-反应,发生复分解反应,不能大量共存,故D不选;
故选A.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应及氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列反应中属于氧化还原反应,且水既不作氧化剂又不作还原剂的是( )
| A、SO3+H2O=H2SO4 | ||||
| B、Cl2+H2O=HCl+HClO | ||||
| C、2F2+2H2O=4HF+O2 | ||||
D、C+H2O
|
下列电离方程式中,书写正确的是( )
| A、Na2SO4=2Na++SO4-2 |
| B、Ba(OH)2=Ba2++(OH-)2 |
| C、KClO3=K++Cl-+3O2- |
| D、Fe2(SO4)3=2Fe3++3SO42- |
在一定温度下,容积不变的密闭容器中发生反应:C(s)+H2O(g)?CO(g)+H2(g),下列叙述不能认定该可逆反应已经达到平衡状态的是( )
| A、混合气体压强不再发生变化 |
| B、混合气体质量不再发生变化 |
| C、反应中CO与H2的物质的量之比为1:1 |
| D、生成nmolCO的同时生成nmolH2O |
化学与社会、环境等密切相关,下列有关说法中不正确的是( )
| A、利用铜、锶、钡等金属化合物的焰色反应制造节日烟花 |
| B、单质硅是将太阳能转化为电能的常用材料 |
| C、PM2.5含有的铅、镉、铬、钒、砷等元素均为对人体有害的金属元素 |
| D、“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展经济模式.利用CO2合成聚碳酸酯类可降低塑料的做法符合“低碳经济”的要求 |
 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
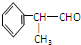 的物质,该物质是一种香料.
的物质,该物质是一种香料.