题目内容
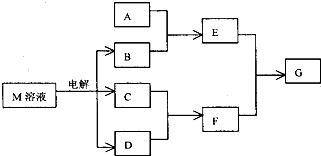 已知M是由X、Y两种位于同周期的元素组成的离子化合物,且X+与氖原子具有相同的电子层结构,Y元素的最高正价与它的负价代数和为6.M与相关物质的转化关系如图(部分产物已略去):
已知M是由X、Y两种位于同周期的元素组成的离子化合物,且X+与氖原子具有相同的电子层结构,Y元素的最高正价与它的负价代数和为6.M与相关物质的转化关系如图(部分产物已略去):请回答下列问题:
(1)Y元素在元素周期表中的位置
(2)若A元素是与X位于同一周期的金属元素,则A的单质与B溶液反应的化学方程式是
(3)若A是一种常见酸性氧化物,且可用于制造玻璃和光导纤维,则A属于
(4)若A与C为同种物质,往足量的E溶液中滴加少量的Na2S溶液,振荡后无明显现象,再加入用盐酸酸化后的BaCl2溶液,有白色沉淀生成,则E与Na2S溶液反应的离子方程式为
考点:无机物的推断
专题:推断题
分析:X、Y是短周期元素,X+与氖原子具有相同的电子层结构,该元素是Na元素,Y元素最高正价与它的负价代数和为6,最高正价与最低负价的绝对值是8,O元素没有正价,则Y是Cl元素,X和Y是同一周期元素,X是Na元素,Y是Cl元素,则M是NaCl,由转化关系可知B为NaOH,F为HCl,
(1)Y是Cl元素,位于周期表第3周期ⅦA族,电解氯化钠溶液生成氢氧化钠、氯气和氢气;
(2)若A元素是与X位于同一周期的金属元素,能与NaOH溶液反应,则A为Al;
(3)若A是一种常见酸性氧化物,且可用于制造玻璃和光导纤维,应为二氧化硅,E应为NaSiO3;
(4)若A与C为同种物质,应为氯气,E为次氯酸钠溶液,与硫离子反应生成硫酸根离子,加盐酸酸化的BaCl2溶液生成硫酸钡沉淀.
(1)Y是Cl元素,位于周期表第3周期ⅦA族,电解氯化钠溶液生成氢氧化钠、氯气和氢气;
(2)若A元素是与X位于同一周期的金属元素,能与NaOH溶液反应,则A为Al;
(3)若A是一种常见酸性氧化物,且可用于制造玻璃和光导纤维,应为二氧化硅,E应为NaSiO3;
(4)若A与C为同种物质,应为氯气,E为次氯酸钠溶液,与硫离子反应生成硫酸根离子,加盐酸酸化的BaCl2溶液生成硫酸钡沉淀.
解答:
解:X、Y是短周期元素,X+与氖原子具有相同的电子层结构,该元素是Na元素,Y元素最高正价与它的负价代数和为6,最高正价与最低负价的绝对值是8,O元素没有正价,则Y是Cl元素,X和Y是同一周期元素,X是Na元素,Y是Cl元素,则M是NaCl,由转化关系可知B为NaOH,F为HCl,
(1)Y是Cl元素,位于周期表第3周期ⅦA族,电解氯化钠溶液生成氢氧化钠、氯气和氢气,方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,
故答案为:第3周期ⅦA族;2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(2)若A是与X、Y同周期的一种常见金属,则A是铝,铝能和氢氧化钠反应,则B是氢氧化钠,C、D是氯气和氢气,氯气和氢气反应生成F氯化氢,铝和氢氧化钠反应生成偏铝酸钠,偏铝酸钠和盐酸反应生成白色胶状沉淀G,则G是氢氧化铝,A与B溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)若A是一种常见酸性氧化物,且可用于制造玻璃和光导纤维,应为二氧化硅,属于原子晶体,E应为NaSiO3,反应的离子方程式为2H++SiO32-=H2SiO3↓,
故答案为:原子;2H++SiO32-=H2SiO3↓;
(4)若A与C为同种物质,应为氯气,E为次氯酸钠溶液,与硫离子反应生成硫酸根离子,加盐酸酸化的BaCl2溶液生成硫酸钡沉淀,E与Na2S溶液反应的离子方程式为S2-+4ClO-=4Cl-+SO42-,故答案为:S2-+4ClO-=4Cl-+SO42-.
(1)Y是Cl元素,位于周期表第3周期ⅦA族,电解氯化钠溶液生成氢氧化钠、氯气和氢气,方程式为2NaCl+2H2O
| ||
故答案为:第3周期ⅦA族;2NaCl+2H2O
| ||
(2)若A是与X、Y同周期的一种常见金属,则A是铝,铝能和氢氧化钠反应,则B是氢氧化钠,C、D是氯气和氢气,氯气和氢气反应生成F氯化氢,铝和氢氧化钠反应生成偏铝酸钠,偏铝酸钠和盐酸反应生成白色胶状沉淀G,则G是氢氧化铝,A与B溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)若A是一种常见酸性氧化物,且可用于制造玻璃和光导纤维,应为二氧化硅,属于原子晶体,E应为NaSiO3,反应的离子方程式为2H++SiO32-=H2SiO3↓,
故答案为:原子;2H++SiO32-=H2SiO3↓;
(4)若A与C为同种物质,应为氯气,E为次氯酸钠溶液,与硫离子反应生成硫酸根离子,加盐酸酸化的BaCl2溶液生成硫酸钡沉淀,E与Na2S溶液反应的离子方程式为S2-+4ClO-=4Cl-+SO42-,故答案为:S2-+4ClO-=4Cl-+SO42-.
点评:本题考查元素化合物的特性和反应,用框图设问可以考查学生正向思维、逆向思维、发散和收敛思维,能根据题眼正确判断化合物是解本题的关键,注意铝和氢氧化钠溶液的反应中,水作反应物,容易漏写,为易错点.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
下列离子方程式书写正确的是( )
| A、AgCl沉淀在氨水中溶解:AgCl+2NH3?H2O═Ag(NH3)2++Cl-+2H2O |
| B、碳酸氢钡溶液中加入过量氢氧化钠溶液:Ba2++HCO3-+OH-=BaCO3↓+H2O |
| C、氨气通入醋酸溶液中:NH3+H+=NH4+ |
| D、向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |
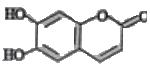 中药狼把草的成分之一M具有清炎杀菌作用,M的结构如右图所示:下列叙述正确的是( )
中药狼把草的成分之一M具有清炎杀菌作用,M的结构如右图所示:下列叙述正确的是( )| A、M既能与H2发生加成反应又能使酸性KMnO4溶液褪色 |
| B、1 mol M最多能与2mol Br2发生反应 |
| C、M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
| D、M既能与FeCl3溶液发生显色反应又能与NaHCO3反应放出CO2 |
下列关于酶的叙述中错误的是( )
| A、酶是一种具有催化作用大的蛋白质 |
| B、酶的催化作用具有专一性和高效性 |
| C、高温或重金属盐能降低酶的活性 |
| D、酶只有在强酸或强碱的条件下才能发挥作用 |
下列与有机物结构、性质相关的叙述错误的是( )
| A、甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 |
| B、蛋白质、乙酸和葡萄糖均属电解质 |
| C、用高锰酸钾酸性溶液可区分乙烷和乙烯 |
| D、蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 |
对于常温下pH为2的盐酸,叙述正确的是( )
| A、c(H+)=c(Cl-)+c(OH-) |
| B、与等体积pH=12的氨水混合后所得溶液显酸性 |
| C、由H2O电离出的c(H+)=1.0×10-12mol?L-1 |
| D、与等体积0.01 mol?L-1乙酸钠溶液混合后溶液中:c(Cl-)=c(CH3COO-) |
在标准状况下,将1.12L由X、Y组成的混合气体用水全部吸收得到1L溶液,测得溶液的pH=1,则X、Y及其体积比可能是( )
| A、H2,Cl2; 1:1 |
| B、NO2,O2;4:1 |
| C、HCl,HBr;1:1 |
| D、Cl2,SO2;1:1 |