题目内容
4.将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中的Fe2+和Fe3+的物质的量浓度相等,则已反应的Fe3+和原溶液中Fe3+总物质的量之比是( )| A. | 2:3 | B. | 3:2 | C. | 2:5 | D. | 5:2 |
分析 铁粉放入三氯化铁溶液中发生反应生成氯化亚铁,根据方程式设反应的三价铁的量,就可以获得生成的亚铁的量,进而获得未反应的Fe3+的物质的量,原溶液中Fe3+总物质的量是反应和未反应的量之和,由此分析解答.
解答 解:铁粉放入三氯化铁溶液中,发生的反应为:Fe+2Fe3+=3Fe2+,已反应的Fe3+的物质的量为n,则
Fe+2Fe3+=3Fe2+,
2 3
n 1.5n
溶液中的Fe3+和Fe2+浓度相等,所以,未反应的Fe3+的物质的量为1.5n,所以已反应的Fe3+和未反应的Fe3+的物质的量之比=n:1.5n=2:3,所以已反应的Fe3+和原溶液中Fe3+总物质的量之比是2:(2+3)=2:5,
故选C.
点评 本题是一道关于三价铁和亚铁之间相互转化的题目,要求学生学会利用化学方程式解答问题的能力,难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
14.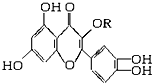 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 1mol该物质可与5molNaOH发生反应 | |
| B. | 1mol该物质与足量溴水反应,最多消耗6molBr2 | |
| C. | 一定条件下1mol该物质可与H2加成,消耗H2最大量为6mol | |
| D. | 维生素P能发生水解反应 |
15.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | Na2O和Na2O2的混合物共1mol,阴离子数目在NA~2NA之间 | |
| B. | 1mol OH-和1mol-OH (羟基)中含有的质子数均为9NA | |
| C. | 铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标准状况下) | |
| D. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
19.下列说法正确的是( )
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 点燃的镁条插入盛CO2的集气瓶中,迅速熄灭 | |
| C. | 铝在高温下能还原锰、铁、铬等金属氧化物 | |
| D. | 镁比铝活泼,更容易与NaOH溶液反应放出H2 |
16.下列各组物质混合后,不能生成氢氧化钠的是( )
| A. | 钠和水 | B. | 过氧化钠和水 | ||
| C. | 氢氧化钙溶液和碳酸钠溶液 | D. | 氢氧化钙溶液和氯化钠溶液 |
13.下列说法正确的是( )
| A. | 一定条件反应:2CO(g)?CO2(g)+C(s)可自发进行,则该反应的△H>0 | |
| B. | 向硫酸亚铁溶液中滴加硫氰化钾溶液产生血红色沉淀说明硫酸亚铁溶液已变质 | |
| C. | 升高CH3COONa溶液温度,其水的离子积常数和pH值都增大 | |
| D. | 相同物质的量浓度的下列溶液:①NH4HSO4②NH4Cl③NH3•H2O,水电离程度由大到小的顺序是:①>②>③ |