题目内容
15.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | Na2O和Na2O2的混合物共1mol,阴离子数目在NA~2NA之间 | |
| B. | 1mol OH-和1mol-OH (羟基)中含有的质子数均为9NA | |
| C. | 铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标准状况下) | |
| D. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
分析 A、氧化钠和过氧化钠中均由2个钠离子和1个阴离子构成;
B、羟基中含9个质子,氢氧根中也含9个质子;
C、铁做电极电解饱和食盐水,则阳极上放电的是铁单质;
D、合成氨的反应为可逆反应.
解答 解:A、氧化钠和过氧化钠中均由2个钠离子和1个阴离子构成,故1mol氧化钠和过氧化钠的混合物中含有的阴离子为1mol即NA个,故A错误;
B、羟基中含9个质子,氢氧根中也含9个质子,故1mol氢氧根和1mol-OH中含有的质子数均为9NA个,故B正确;
C、铁做电极电解饱和食盐水,则阳极上放电的是铁单质,不会生成气体,故C错误;
D、合成氨的反应为可逆反应,不能进行完全,故转移的电子数小于0.6NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
5.已知HF的酸性比HCN的酸性强.现有物质的量浓度和体积均相同的NaF和NaCN两种溶液,已知前者溶液中的离子数目为n1,后者溶液中的离子数目为n2,则下列关系正确的是( )
| A. | n1=n2 | B. | n1>n2 | C. | n1<n2 | D. | C( F-)<C(CN-) |
10.下列各表述与示意图一致的是( )
| A. | 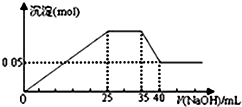 如图表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:1:2,其中使用的NaOH的浓度为2 mol•L-1 | |
| B. |  如图中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)是,△H>0,若使用正催化剂,E值会减小 | |
| C. | 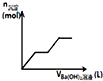 如图可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 | |
| D. | 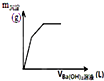 如图表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的质量(m)与加入Ba(OH)2溶液体积(V)之间的关系图 |
4.将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中的Fe2+和Fe3+的物质的量浓度相等,则已反应的Fe3+和原溶液中Fe3+总物质的量之比是( )
| A. | 2:3 | B. | 3:2 | C. | 2:5 | D. | 5:2 |
5.热化学方程式C(s)+H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$CO(g)+H2(g);△H=+131.3kJ/mol表示( )
| A. | 碳和水反应吸收131.3kJ能量 | |
| B. | 1mol碳和1mol水反应生成 一氧化碳和氢气,并吸收131.3kJ热量 | |
| C. | 1mol C(S)和1 mol H2O(g)的能量总和大于1mol H2(g)和1mol CO(g)的能量 | |
| D. | 1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ |
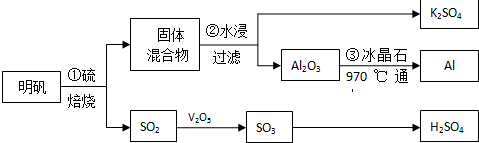

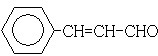 ;
; ;
; 、
、 、
、 、
、 (其中任意两种).
(其中任意两种).