题目内容
1.已知2Fe2++Br2═2Fe3++2Br-,当向100mL的FeBr2溶液中通入标准状况下的Cl2 3.36L,充分反应后测得形成的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2的物质的量浓度为多少?分析 形成的溶液中Cl-和Br-的物质的量浓度相等,可知亚铁离子全部被氧化,n(Cl2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,结合电子守恒计算.
解答 解:设原FeBr2的物质的量浓度为x,
形成的溶液中Cl-和Br-的物质的量浓度相等,
由电子守恒可知,
0.1L×x×(3-2)+(0.1L×x×2-0.15mol×2)×(1-0)=0.15mol×2×(1-0)
解得x=2mol/L
答:原FeBr2的物质的量浓度为2mol/L.
点评 本题考查氧化还原反应的计算,为高频考点,把握离子浓度的关系、氧化的先后顺序、电子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
6.对化工生产认识正确的是( )
| A. | 海水提溴:一般需要经过浓缩、氧化、提取三个步骤 | |
| B. | 合成氯化氢:通入H2的量略大于C12,可以使平衡正移 | |
| C. | 合成氨:采用500℃的高温,有利于增大反应正向进行的程度 | |
| D. | 侯德榜制碱法:析出NaHCO3的母液中加入消石灰,可以循环利用NH3 |
7.下列实验操作、现象、结论和推理均正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀变为红褐色 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| B | 常温下,质量与表面积均相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| D | 向Na2SO3溶液加入稀盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | Na2SO3溶液已变质 |
| A. | A | B. | B | C. | C | D. | D |
9.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol•L-1的Ca(ClO)2溶液中含ClO-数目为NA | |
| B. | 标准状况下,22.4L水中含有的分子数为NA | |
| C. | 92g NO2和N2O4混合气体中含有的原子数为6NA | |
| D. | 1.7g H2O2中含有的电子数为0.9NA |
6.X、Y、Z、W是原子序数依次增大的短周期主族元素,X与Z同主族,X原子的最外层电子数是其电子数的$\frac{2}{3}$,Y和W是同一周期中原子半径相差最大两种元素.下列叙述正确的是( )
| A. | 原子半径:W>Z | |
| B. | X、Y 均能与W形成的离子化合物 | |
| C. | Z、W的气态氢化物的稳定性:Z>W | |
| D. | X、Z的最高价氧化物的水化物酸性:X>Z |
11.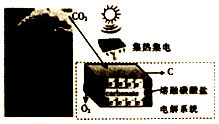 最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生产锂离子电池.下列说法正确的是( )
最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生产锂离子电池.下列说法正确的是( )
 最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生产锂离子电池.下列说法正确的是( )
最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生产锂离子电池.下列说法正确的是( )| A. | 图中能量化方式只有一种 | |
| B. | 阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑ | |
| C. | 若反应中转移1mole-,则理论上消耗CO32-0.5mol | |
| D. | 当生成12g碳材料时,可收集到22.4L O2 |