题目内容
10.2016年10月17日7时30分,神舟十一号载人飞船成功升空.在发射“神舟”号的火箭推进器中装有肼(N2H4)和过氧化氢,当两者混合时即产生气体,并放出大量的热.已知0.4mol液态肼和0.8mol液态H2O2混合反应,生成氮气和水蒸气,放出256.72kJ的热量(相当于25℃、101kPa下测得的热量).(1)反应的热化学方程式为N2H4(l)+2H2O2(l═N2(g)+4H2O(g)△H=-641.8KJ/mol.其中氧化剂是H2O2
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是408.9kJ.
(3)若反应中当有1molN2生成时转移的电子物质的量是4mol
(4)此反应用于火箭推进,除释放大量热和产生气体外,还有一个很大的优点是产物不会造成环境污染.
分析 (1)由信息可知,0.4mol液态肼和0.8mol液态H2O2混合反应,生成氮气和水蒸气,放出256.72kJ的热量,则1mol液态肼和液态H2O2混合反应,生成氮气和水蒸气,放出热量为$\frac{256.72kJ}{0.4}$=641.8kJ,且N元素的化合价升高,O元素的化合价降低;
(2)①N2H4(l)+2H2O2(l═N2(g)+4H2O(g)△H=-641.8 KJ/mol
②H2O(l)=H2O(g)△H=+44kJ/mol,
由盖斯定律可知,①-②×4得到N2H4(l)+2H2O2(l═N2(g)+4H2O(l);
(3)N元素的化合价由-2价升高为0;
(4)该反应的产物均无毒、无害.
解答 解:(1)由信息可知,0.4mol液态肼和0.8mol液态H2O2混合反应,生成氮气和水蒸气,放出256.72kJ的热量,则1mol液态肼和液态H2O2混合反应,生成氮气和水蒸气,放出热量为$\frac{256.72kJ}{0.4}$=641.8kJ,则热化学方程式为N2H4(l)+2H2O2(l═N2(g)+4H2O(g)△H=-641.8 KJ/mol;O元素的化合价降低,氧化剂为H2O2,
故答案为:N2H4(l)+2H2O2(l═N2(g)+4H2O(g)△H=-641.8 KJ/mol;H2O2;
(2)(2)①N2H4(l)+2H2O2(l═N2(g)+4H2O(g)△H=-641.8 KJ/mol
②H2O(l)=H2O(g)△H=+44kJ/mol,
由盖斯定律可知,①-②×4得到N2H4(l)+2H2O2(l═N2(g)+4H2O(l)△H=(-641.8 KJ/mol)-(44kJ/mol)×4=-817.8kJ/mol,
则16g液态肼与液态双氧水反应生成液态水时放出的热量是$\frac{16g}{32g/mol}$×(817.8kJ/mol)=408.9kJ,
故答案为:408.9;
(3)当有1molN2生成时转移的电子物质的量是1mol×2×(2-0)=4mol,故答案为:4mol;
(4)此反应用于火箭推进,除释放大量热和产生气体外,还有一个很大的优点是产物不会造成环境污染,
故答案为:产物不会造成环境污染.
点评 本题考查热化学方程式,为高频考点,把握反应中能量变化、盖斯定律的应用、氧化还原反应等为解答的关键,侧重分析与应用能力的考查,注意焓变与热量的关系,题目难度不大.

 阅读快车系列答案
阅读快车系列答案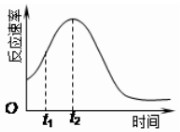 某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.
某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:….
(1)猜想Ⅱ可能是:生成的Mn2+在反应中起到催化剂的作用,加快了反应速率
(2)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容.
| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4,少量MnSO4(s)固体(填物质名称) |
| 实验现象(褪色时间) | 褪色时间10min | 褪色时间<10min(选填“<”“>”或“=”) |
| 结论 | 猜想Ⅱ正确 | |
 某油库为了强化安全管理,引进一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法不正确的是( )
某油库为了强化安全管理,引进一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法不正确的是( )| A. | 石墨电极作正极,发生还原反应 | |
| B. | H+由质子交换膜右侧向左侧迁移 | |
| C. | 每消耗标况下5.6LO2,电路中通过1 mol电子 | |
| D. | 铂电极的电极反应式:C8H18+16H20-5Oe-═8CO2↑+50H+ |
| A. | 制备无水AlCl3时,加入的SOCl2只起脱水剂作用 | |
| B. | 电池工作过程中,SOCl2被还原为Li2SO3和S单质 | |
| C. | 电池工作过程中,电子经电解质溶液流向锂电极 | |
| D. | 用该电池电解水,生成2mol H2,消耗1.5molSOCl2 |
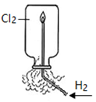
 A元素最简单的氢化物的电子式为
A元素最简单的氢化物的电子式为 .
.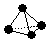 ,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.写出B4转化为B2的热化学方程式:N4(g)=2N2(g)△H=-882kJ•mol-1;
,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.写出B4转化为B2的热化学方程式:N4(g)=2N2(g)△H=-882kJ•mol-1;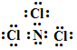 ;X遇水蒸气可形成一种常见的漂白性物质.则X与水反应的化学方程式是NCl3+3H2O=NH3↑+3HClO.
;X遇水蒸气可形成一种常见的漂白性物质.则X与水反应的化学方程式是NCl3+3H2O=NH3↑+3HClO.