题目内容
16.现有4g氢氧化钠恰好与100mL的盐酸完全反应,试计算(写计算过程)(1)氢氧化钠的物质的量
(2)盐酸的物质的量浓度.
分析 发生NaOH+HCl=NaCl+H2O,n(NaOH)=$\frac{4g}{40g/mol}$=0.1mol,结合反应及c=$\frac{n}{V}$计算.
解答 解:(1)n(NaOH)=$\frac{4g}{40g/mol}$=0.1mol,答:氢氧化钠的物质的量为0.1mol;
(2)由NaOH+HCl=NaCl+H2O可知,n(HCl)=n(NaOH)=0.1mol,其浓度为$\frac{0.1mol}{0.1L}$=1mol/L,答:盐酸的物质的量浓度为1mol/L.
点评 本题考查化学反应的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意物质的量的基本计算公式的应用,题目难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
1.有关漂白精的认识错误的是( )
| A. | 漂白精的主要成分是次氯酸钙 | B. | 漂白精露置在空气中会失效 | ||
| C. | 漂白精水溶液具有漂白性 | D. | 漂白精杀菌效果随pH降低而增强 |
2.某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:下列说法正确的是( )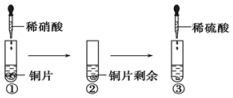

| A. | ①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2 | |
| B. | ②中溶液存在:c(Cu2+)+c(H+)=c(NO3-)+c(OH-) | |
| C. | 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应 | |
| D. | ③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O |
4.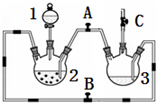 某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.
(1)稀硫酸应放在1中(填写仪器编号).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关AC、打开开关B就可观察到氢氧化亚铁的颜色.试分析实验开始时排尽装置中空气的理由防止生成的氢氧化亚铁被氧化.
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是在仪器2底部放上一块吸铁石(或将铁粉改成铁钉).
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4•FeSO4•6H2O](式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D.
A.用冷水洗
B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗
D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如下:
则该产品纯度为$\frac{980c}{a}$×100%.上表中第一次实验中记录数据明显大于后两次,其原因可能是BC.
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
 某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.(1)稀硫酸应放在1中(填写仪器编号).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关AC、打开开关B就可观察到氢氧化亚铁的颜色.试分析实验开始时排尽装置中空气的理由防止生成的氢氧化亚铁被氧化.
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是在仪器2底部放上一块吸铁石(或将铁粉改成铁钉).
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4•FeSO4•6H2O](式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D.
A.用冷水洗
B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗
D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,11.2LCH4含有5NA个电子 | |
| B. | 标准状况下,22.4L氦气含有2NA个原子 | |
| C. | 常温常压下,22.4L CO2和SO2混合气体含有2NA个氧原子 | |
| D. | 46gNO2和N2O4的混合气体含氮原子数为NA个 |
8.如表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题.
(1)单质化学性质最不活泼的是Ne;
(2)地壳中含量最多的元素是氧(填名称);
(3)单质常用作半导体材料的是Si;
(4)Mg原子结构示意图为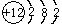 ;
;
(5)O和S中,原子半径较大的是S;
(6)CH4和NH3中,热稳定性较强的是NH3(或氨气);
(7)新制氯水有漂白作用,是因为其中含有HClO(填“HCl”或“HCIO”);
(8)元素最高价氧化物对应水化物中,碱性最强的是NaOH(填化学式),两性氢氧化物是 Al(OH)3(填化学式);
(9)某烃分子中含有6个碳原子,结构简式为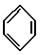 ,常用作有机溶剂.该有机物分子式为 C6H6 ,其中碳元素与氢元素的质量比m(C):m(H)=12:1(相对原子质量:H-1 C-12)
,常用作有机溶剂.该有机物分子式为 C6H6 ,其中碳元素与氢元素的质量比m(C):m(H)=12:1(相对原子质量:H-1 C-12)
| 族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)地壳中含量最多的元素是氧(填名称);
(3)单质常用作半导体材料的是Si;
(4)Mg原子结构示意图为
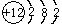 ;
;(5)O和S中,原子半径较大的是S;
(6)CH4和NH3中,热稳定性较强的是NH3(或氨气);
(7)新制氯水有漂白作用,是因为其中含有HClO(填“HCl”或“HCIO”);
(8)元素最高价氧化物对应水化物中,碱性最强的是NaOH(填化学式),两性氢氧化物是 Al(OH)3(填化学式);
(9)某烃分子中含有6个碳原子,结构简式为
 ,常用作有机溶剂.该有机物分子式为 C6H6 ,其中碳元素与氢元素的质量比m(C):m(H)=12:1(相对原子质量:H-1 C-12)
,常用作有机溶剂.该有机物分子式为 C6H6 ,其中碳元素与氢元素的质量比m(C):m(H)=12:1(相对原子质量:H-1 C-12)
6.在含有大量的Na+、H+、NO3-的溶液中,还可能大量存在的离子是( )
| A. | Fe2+ | B. | HCO3- | C. | OH- | D. | NH4+ |