题目内容
7.下列实验操作、现象、结论和推理均正确的是( )| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀变为红褐色 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| B | 常温下,质量与表面积均相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| D | 向Na2SO3溶液加入稀盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | Na2SO3溶液已变质 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氢氧化钠过量,铁离子直接与氢氧化钠反应生成氢氧化铁沉淀,无法比较二者溶度积大小;
B.常温下铝与浓硫酸发生钝化,阻止了反应的继续进行;
C.下层溶液显紫红色,说明铁离子将碘离子氧化成碘单质;
D.酸性条件下硝酸根离子能够氧化亚硫酸根离子,干扰了检验结果.
解答 解:A.加入的NaOH应该少量,否则铁离子直接与氢氧化钠反应,无法判断Ksp[Mg(OH)2]、Ksp[Fe(OH)3]的大小,故A错误;
B.常温下,质量与表面积均相同的铝片分别投入足量的稀、浓硫酸中,Al与浓硫酸发生钝化,则稀硫酸中铝先溶解完,故B错误;
C.将KI和FeCl3溶液在试管中混合后,加入CCl4振荡、静置,下层溶液显紫红色,说明有碘单质生成,可证明氧化性:Fe3+>I2,故C正确;
D.加入酸化的Ba(NO3)2溶液后,硝酸根离子在酸性条件下能够氧化亚硫酸根离子,干扰了检验,应该选用氯化钡溶液,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及难溶物溶度积大小比较、钝化现象、氧化还原反应、离子检验等知识,明确常见元素及其化合物性质为解答关键,D为易错点,注意酸性条件下硝酸根离子具有强氧化性,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
17.下列关于有机化合物的叙述符合事实的是( )
| A. | 乙烯使溴水和酸性高锰酸钾溶液褪色的反应都属于氧化反应 | |
| B. | 乙酸和乙醇均能与NaOH溶液发生反应 | |
| C. | 苯与溴水混合后加入FeBr3做催化剂,可发生取代反应生成溴苯 | |
| D. | C5H11Br有8种同分异构体,它们的熔点、沸点各不相同 |
18.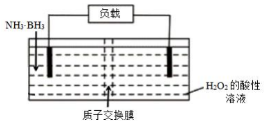 氨硼烷(NH3•BH3)电池可在常温下工作,装置如图.该电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O. 下列说法正确的是( )
氨硼烷(NH3•BH3)电池可在常温下工作,装置如图.该电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O. 下列说法正确的是( )
 氨硼烷(NH3•BH3)电池可在常温下工作,装置如图.该电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O. 下列说法正确的是( )
氨硼烷(NH3•BH3)电池可在常温下工作,装置如图.该电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O. 下列说法正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | BO2-通过质子交换膜向正极移动 | |
| C. | 负极附近溶液pH增大 | |
| D. | 正极的反应式为 3H2O2+6H++6e-═6H2O |
2.某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:下列说法正确的是( )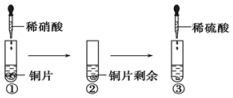

| A. | ①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2 | |
| B. | ②中溶液存在:c(Cu2+)+c(H+)=c(NO3-)+c(OH-) | |
| C. | 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应 | |
| D. | ③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O |
12.下列叙述正确的是( )
| A. | K+、ClO‐、SO42‐、HCO3‐一定能共存于 c(Fe3+)=0.1mol•L‐l 的溶液中 | |
| B. | 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 在NaClO和NaCl混合溶液中滴入过量SO2气体,反应的离子方程式为:SO2+3C1O‐+H2O═SO42‐+C1‐+2HClO | |
| D. | Na+、HCO3-、Br-、Mg2+可以在 pH=8 的溶液中共存 |
4.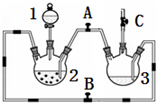 某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.
(1)稀硫酸应放在1中(填写仪器编号).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关AC、打开开关B就可观察到氢氧化亚铁的颜色.试分析实验开始时排尽装置中空气的理由防止生成的氢氧化亚铁被氧化.
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是在仪器2底部放上一块吸铁石(或将铁粉改成铁钉).
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4•FeSO4•6H2O](式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D.
A.用冷水洗
B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗
D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如下:
则该产品纯度为$\frac{980c}{a}$×100%.上表中第一次实验中记录数据明显大于后两次,其原因可能是BC.
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
 某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.(1)稀硫酸应放在1中(填写仪器编号).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关AC、打开开关B就可观察到氢氧化亚铁的颜色.试分析实验开始时排尽装置中空气的理由防止生成的氢氧化亚铁被氧化.
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是在仪器2底部放上一块吸铁石(或将铁粉改成铁钉).
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4•FeSO4•6H2O](式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D.
A.用冷水洗
B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗
D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.