题目内容
11.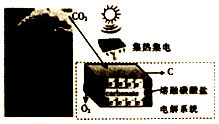 最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生产锂离子电池.下列说法正确的是( )
最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生产锂离子电池.下列说法正确的是( )| A. | 图中能量化方式只有一种 | |
| B. | 阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑ | |
| C. | 若反应中转移1mole-,则理论上消耗CO32-0.5mol | |
| D. | 当生成12g碳材料时,可收集到22.4L O2 |
分析 由图可知,太阳能转化为电能,电能转化为化学能,可能还伴随热量的产生,电解二氧化碳得到碳材料,则阴极上3CO2+4e-=C+2CO32-,阳极上2CO32--4e-=2CO2↑+O2↑,总反应为CO2$\frac{\underline{\;电解\;}}{\;}$C+O2↑,以此来解答.
解答 解:A.能量转化不止一只,阳能转化为电能,电能转化为化学能,可能还伴随热量的产生,故A错误;
B.阳极失去电子,发生氧化反应,电极反应式为2CO32--4e-=2CO2↑+O2↑,故B正确;
C.总反应为CO2$\frac{\underline{\;电解\;}}{\;}$C+O2↑,若反应中转移1mole-,不消耗CO32-,故C错误;
D.当生成12g碳材料时,生成1molO2,Vm未知,不能计算其体积,故D错误;
故选B.
点评 本题考查电解原理,为高频考点,把握图中能量变化、电极反应为解答的关键,侧重分析与应用能力的考查,注意总反应及电极反应的应用,题目难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
19.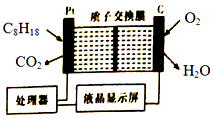 某油库为了强化安全管理,引进一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法不正确的是( )
某油库为了强化安全管理,引进一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法不正确的是( )
 某油库为了强化安全管理,引进一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法不正确的是( )
某油库为了强化安全管理,引进一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法不正确的是( )| A. | 石墨电极作正极,发生还原反应 | |
| B. | H+由质子交换膜右侧向左侧迁移 | |
| C. | 每消耗标况下5.6LO2,电路中通过1 mol电子 | |
| D. | 铂电极的电极反应式:C8H18+16H20-5Oe-═8CO2↑+50H+ |
6.在含有大量的Na+、H+、NO3-的溶液中,还可能大量存在的离子是( )
| A. | Fe2+ | B. | HCO3- | C. | OH- | D. | NH4+ |
16.已知自然界氧的同位素有16O、17O、18O,与氢的其中两种同位素H、D组成水分子,从水分子的原子组成来看,此水一共有( )
| A. | 3种 | B. | 18种 | C. | 9种 | D. | 12种 |
3.下列关于离子共存或离子反应的说法正确的是( )
| A. | 某无色溶液中可能大量存在:H+、Cl-、MnO${\;}_{4}^{-}$ | |
| B. | 室温下由水电离的 c(OH-)=1×10-12mol•L-1的溶液中能大量共存:K+、Na+、Cl-、HCO3- | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2 Fe3++2 Br2+6 Cl- | |
| D. | 稀硫酸和Ba(OH)2溶液反应:H++SO${\;}_{4}^{2-}$+Ba2++OH-═BaSO4↓+H2O |
20.有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,电池总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S.已知亚硫酰氯和AlCl3•6H2O混合共热蒸干,可制得无水AlCl3.则下列叙述中正确的是( )
| A. | 制备无水AlCl3时,加入的SOCl2只起脱水剂作用 | |
| B. | 电池工作过程中,SOCl2被还原为Li2SO3和S单质 | |
| C. | 电池工作过程中,电子经电解质溶液流向锂电极 | |
| D. | 用该电池电解水,生成2mol H2,消耗1.5molSOCl2 |
1.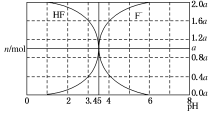 25℃时,用 2a mol•L-1 NaOH 溶液滴定 1.0L 2a mol•L-1氢氟酸溶液,得到混合液中 HF、F-的物质的量与溶液 pH 的变化如图所示.下列说法正确的是( )
25℃时,用 2a mol•L-1 NaOH 溶液滴定 1.0L 2a mol•L-1氢氟酸溶液,得到混合液中 HF、F-的物质的量与溶液 pH 的变化如图所示.下列说法正确的是( )
 25℃时,用 2a mol•L-1 NaOH 溶液滴定 1.0L 2a mol•L-1氢氟酸溶液,得到混合液中 HF、F-的物质的量与溶液 pH 的变化如图所示.下列说法正确的是( )
25℃时,用 2a mol•L-1 NaOH 溶液滴定 1.0L 2a mol•L-1氢氟酸溶液,得到混合液中 HF、F-的物质的量与溶液 pH 的变化如图所示.下列说法正确的是( )| A. | pH=3 时,溶液中:c(Na+)>c(F-) | |
| B. | c(F-)>c(HF)时,溶液一定呈碱性 | |
| C. | pH=4 时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)<2a mol?L-1 | |
| D. | pH=3.45 时,NaOH 溶液恰好与 HF 完全反应 |