题目内容
6.对化工生产认识正确的是( )| A. | 海水提溴:一般需要经过浓缩、氧化、提取三个步骤 | |
| B. | 合成氯化氢:通入H2的量略大于C12,可以使平衡正移 | |
| C. | 合成氨:采用500℃的高温,有利于增大反应正向进行的程度 | |
| D. | 侯德榜制碱法:析出NaHCO3的母液中加入消石灰,可以循环利用NH3 |
分析 A.海水中溴离子含量较低,应先浓缩富集,将溴离子转化为溴需要加入氧化剂,再利用溴的挥发性,鼓入热空气或热水蒸气将溴分离出来;
B.氢气与氯气反应生成氯化氢不是可逆反应;
C.合成氨为放热反应;
D.析出小苏打的母液中加入生石灰,NH3循环使用.
解答 解:A.海水中溴离子含量较低,应先浓缩富集,将溴离子转化为溴需要加入氧化剂,通常选择氯气,氧化溴离子得到单质溴:2Br-+Cl2═Br2+2Cl-,再利用溴的挥发性,鼓入热空气或热水蒸气将溴分离出来,故A正确;
B.氢气与氯气反应生成氯化氢不是可逆反应,不存在化学平衡的移动,故B错误;
C.合成氨为放热反应,加热使平衡逆向移动,故C错误;
D.侯德榜制碱法:析出NaHCO3的母液中加入生石灰,可以循环利用NH3,故D错误;
故选:A.
点评 本题考查了物质结构与性质,涉及海水提溴、合成氨条件的选择、侯氏制碱,明确相关原理是解题关键,题目难度中等.

练习册系列答案
相关题目
17.下列关于有机化合物的叙述符合事实的是( )
| A. | 乙烯使溴水和酸性高锰酸钾溶液褪色的反应都属于氧化反应 | |
| B. | 乙酸和乙醇均能与NaOH溶液发生反应 | |
| C. | 苯与溴水混合后加入FeBr3做催化剂,可发生取代反应生成溴苯 | |
| D. | C5H11Br有8种同分异构体,它们的熔点、沸点各不相同 |
14.可用铝热反应冶炼的金属是( )
| A. | W | B. | Na | C. | Mg | D. | Hg |
1.有关漂白精的认识错误的是( )
| A. | 漂白精的主要成分是次氯酸钙 | B. | 漂白精露置在空气中会失效 | ||
| C. | 漂白精水溶液具有漂白性 | D. | 漂白精杀菌效果随pH降低而增强 |
11.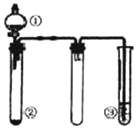 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )
 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
| B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 |
| C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 |
| D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |
| A. | A | B. | B | C. | C | D. | D |
18.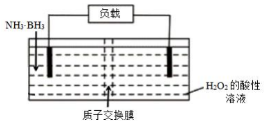 氨硼烷(NH3•BH3)电池可在常温下工作,装置如图.该电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O. 下列说法正确的是( )
氨硼烷(NH3•BH3)电池可在常温下工作,装置如图.该电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O. 下列说法正确的是( )
 氨硼烷(NH3•BH3)电池可在常温下工作,装置如图.该电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O. 下列说法正确的是( )
氨硼烷(NH3•BH3)电池可在常温下工作,装置如图.该电池工作时的总反应为:NH3•BH3+3H2O2═NH4BO2+4H2O. 下列说法正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | BO2-通过质子交换膜向正极移动 | |
| C. | 负极附近溶液pH增大 | |
| D. | 正极的反应式为 3H2O2+6H++6e-═6H2O |