题目内容
13.Ⅰ.氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.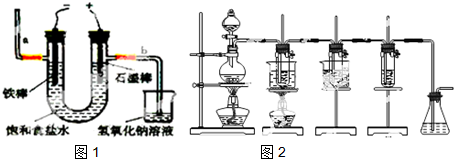
工业上通常采用电解法制氯气:观察如图1,回答:
(1)若饱和食盐水中含有酚酞,通电后a(填a或b)侧先变红.
(2)检验b极产物的方法是用湿润的淀粉碘化钾试纸靠近管口,若变蓝色,则证明产生了Cl2.
(3)生产的氯气常用于制备漂白粉,请写出漂白粉长期露置在空气中失效,且属于氧化还原反应的一条化学方程式,并用双线桥法分析:
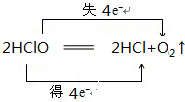 .
.Ⅱ.在实验室里可用如图2所示装置来制取氯酸钠、次氯酸钠和探究氯水的性质.图中:
①为氯气发生装置;②的试管里盛有15mL 30% NaOH溶液来制取氯酸钠,并置于热水浴中;
③的试管里盛有15mL 8% NaOH溶液来制取次氯酸钠,并置于冰水浴中;
④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.请填写下列空白:
①②③④⑤
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.请写出实验室制Cl2的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有C(填写字母)的净化装置.
A.碱石灰 B.氢氧化钠溶液C.饱和食盐水 D.浓硫酸
(2)如果将过量二氧化锰与20mL 12mol•L-1的浓盐酸混合加热,充分反应后生成的氯气小于0.06mol.(填“大于”“小于”“等于”),若有17.4g的MnO2被还原,则被氧化的HCl质量为14.6g.
(3)比较制取氯酸钠和次氯酸钠的条件,二者的差异是①所用NaOH浓度不同;②反应控制的温度不同
(4)长时间反应后,实验中可观察到④的试管里溶液的依次出现的现象是紫色变红色,然后褪色,最后呈黄绿色.
分析 Ⅰ.(1)电解饱和食盐水可以得到氢氧化钠、氯气和氢气,在阳极产生氯气,阴极产生氢氧化钠、氯气;
(2)b极为阳极,其产物为氯气,可以用用湿润的淀粉碘化钾试纸检验;
(3)漂白粉长期露置在空气中失效,且属于氧化还原反应的反应为次氯酸的分解反应生成氯化氢和氧气;
Ⅱ.(1)实验室制备氯气用浓盐酸和二氧化锰在加热条件反应,所用反应仪器为分液漏斗和圆底烧瓶,可用饱和食盐水除杂;
(2)氯化氢易挥发,二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应;根据二氧化锰和作还原剂的HCl之间的关系式计算;
(3)在加热条件下,氯气与浓NaOH溶液反应生成氯酸钠,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠;
(4)氯气与水反应生成盐酸和次氯酸,反应生成的H+使石蕊变成红色,次氯酸具有强氧化性,将石蕊氧化为无色物质,所以反应现象为先变红,后褪色,反应后如继续通入氯气,氯气微溶于水,则为氯气的溶液,溶液呈黄绿色.
解答 解:Ⅰ.(1)电解饱和食盐水可以得到氢氧化钠、氯气和氢气,在阳极产生氯气,阴极产生氢氧化钠、氯气,所以a侧先变红,
故答案为:a;
(2)b极为阳极,其产物为氯气,检验的方法是用湿润的淀粉碘化钾试纸靠近管口,若变蓝色,则证明产生了Cl2,
故答案为:用湿润的淀粉碘化钾试纸靠近管口,若变蓝色,则证明产生了Cl2;
(3)漂白粉长期露置在空气中失效,且属于氧化还原反应的反应为次氯酸的分解反应生成氯化氢和氧气为 ,
,
故答案为: ;
;
Ⅱ.(1)实验室制备氯气用浓盐酸和二氧化锰在加热条件反应,MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,所用反应仪器为分液漏斗和圆底烧瓶,生成氯气混有HCl气体,根据氯气难溶于饱和氯化钠溶液,HCl易溶于水,可用饱和食盐水除杂,
故答案为:分液漏斗;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;C;
(2)盐酸具有挥发性,加热促进氯化氢的挥发,随着反应的进行,盐酸的浓度逐渐减小,二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应,所以反应生成氯气的物质的量小于0.06mol,17.4gMnO2的物质的量=$\frac{17.4g}{87g/mol}$=0.2mol,该反应中二氧化锰和被氧化的HCl的物质的量之比为1:2,有0.2mol二氧化锰参加反应,则有0.4molHCl被氧化,m(HCl)=nM=0.4mol×36.5g/mol=14.6gg,
故答案为:小于;14.6g;
(3)根据题中信息可知,在加热条件下,氯气与浓NaOH溶液反应生成氯酸钠,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠,二者反应的浓度和温度都不相同.
故答案为:所用NaOH浓度不同;反应控制的温度不同;
(4)氯气与水反应生成盐酸和次氯酸,反应生成的H+使石蕊变成红色,次氯酸具有强氧化性,将石蕊氧化为无色物质,所以反应现象为先变红,后褪色,反应后如继续通入氯气,氯气微溶于水,则为氯气的溶液,溶液呈黄绿色,所以溶液的依次出现的现象是紫色变红色,然后褪色,最后呈黄绿色,
故答案为:紫色变红色,然后褪色,最后呈黄绿色.
点评 本题考查了氯气的实验室制法,题目难度中等,明确氯气的有关化学反应原理是解本题关键,注意掌握氯气的漂白原理,试题知识点较多、综合性较强,充分考查了学生的分析能力及化学实验能力.

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案| A. | 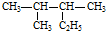 按系统命名法的名称为:2-甲基-3-乙基丁烷 按系统命名法的名称为:2-甲基-3-乙基丁烷 | |
| B. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| C. | 根据纤维在火焰上燃烧产生的气味,可确定该纤维是否为蛋白纤维 | |
| D. | 等质量的甲醛、葡萄糖、纤维素完全燃烧时的耗氧量相等 |
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H
已知:C(s)+O2(g)═CO2(g)△H1
S(s)+2K(s)═K2S(s)△H2
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3
则△H为( )
| A. | △H1+△H2-△H3 | B. | △H3+3△H1-△H2 | C. | 3△H1+△H2-△H3 | D. | △H3+△H1-△H2 |
| A. | 用含增塑剂的聚氯乙烯薄膜作食品包装材料 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| D. | 中国古代用明矾溶液的酸性清洗铜镜表面的铜锈 |
| A. | 生石灰 | B. | 还原铁粉 | C. | 氯化钙 | D. | 硫酸钡 |
| A. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| B. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 | |
| C. | ${\;}_{\;}^{14}$C可用于文物年代的鉴定,${\;}_{\;}^{14}$C与${\;}_{\;}^{12}$C互为同素异形体 | |
| D. | 煤的干馏和石油的分馏均属化学变化 |
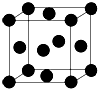 用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如图),已知该晶体的密度为9.00g•cm-3,晶胞中该原子的配位数为12;Cu的原子半径为$\frac{\sqrt{2}}{4}×\root{3}{\frac{4×64}{9.00×6.06×1{0}^{23}}}$cm=1.27×10-8cm(阿伏加德罗常数为NA,列出计算表达式,不用化简).
用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如图),已知该晶体的密度为9.00g•cm-3,晶胞中该原子的配位数为12;Cu的原子半径为$\frac{\sqrt{2}}{4}×\root{3}{\frac{4×64}{9.00×6.06×1{0}^{23}}}$cm=1.27×10-8cm(阿伏加德罗常数为NA,列出计算表达式,不用化简).