题目内容
4.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H
已知:C(s)+O2(g)═CO2(g)△H1
S(s)+2K(s)═K2S(s)△H2
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3
则△H为( )
| A. | △H1+△H2-△H3 | B. | △H3+3△H1-△H2 | C. | 3△H1+△H2-△H3 | D. | △H3+△H1-△H2 |
分析 已知热化学方程式:C(s)+O2(g)=CO2(g)△H1①
S(s)+2K(s)═K2S(s)△H2②
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3③
将方程式3①+②-③得S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),其反应热进行相应的改变,据此计算反应热.
解答 解:碳的燃烧热△H1=a kJ•mol-1,其热化学方程式为C(s)+O2(g)=CO2(g)△H1 ①
S(s)+2K(s)═K2S(s)△H2②
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3③
将方程式3①+②-③得S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),则△H=3△H1+△H2-△H3,故选C.
点评 本题考查盖斯定律的应用,侧重考查学生分析计算能力,明确目标方程式与已知方程式的关系是解本题关键,注意方程式可以进行加减,题目难度不大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
5.下列仪器中一般不用作反应容器的是( )
| A. | 试管 | B. | 烧瓶 | C. | 量筒 | D. | 烧杯 |
6.下列各组物质中,都是由极性键构成的非极性分子的一组是( )
| A. | CS2和SO3 | B. | P4和CH4 | C. | NH3和H2S | D. | CCl4和C2H4 |
19.下列说法正确的是( )
| A. | 标准状况下,22.4 L H2O 的质量为18 g | |
| B. | 0.5 mol O2中含有的分子数约为6.02×1023 | |
| C. | 0.1 mol/L Na2CO3溶液中含Na+的物质的量为0.1 mol | |
| D. | 常温常压下,1.7 g NH3含有的质子数约为6.02×1023 |
14.X、Y、Z、W、M为原子序数依次增大的短周期主族元素.已知:
①原子半径:X<Z<Y<M<W
②原子的最外层电子数:X=W,X+Y=Z=2M
③Y元素的主要化合价:最高正价+最低负价=2
下列说法不正确的是( )
①原子半径:X<Z<Y<M<W
②原子的最外层电子数:X=W,X+Y=Z=2M
③Y元素的主要化合价:最高正价+最低负价=2
下列说法不正确的是( )
| A. | X、Z两种元素可形成X2Z和X2Y2两种常见共价化合物 | |
| B. | 工业上常用电解熔融的W和M氯化物的方法分别制取W、M两种单质 | |
| C. | M的最高价氧化物与Y、W两元素最高价氧化物对应水化物均能反应生成盐和水 | |
| D. | X与W可形成离子化合物,且该离子化合物具有较强还原性 |
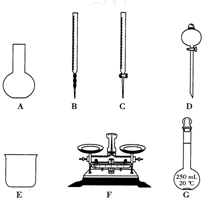 某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验按以下步骤进行:①称取ag样品,置于烧杯中;②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;④加入过量氨水,充分搅拌,使沉淀完全;⑤过滤,洗涤沉淀;⑥将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;⑦…
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验按以下步骤进行:①称取ag样品,置于烧杯中;②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;④加入过量氨水,充分搅拌,使沉淀完全;⑤过滤,洗涤沉淀;⑥将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;⑦…
 .
.