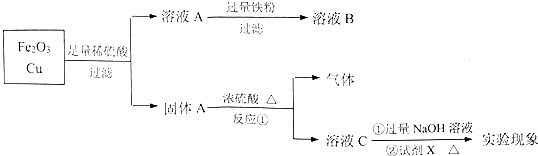
题目内容
17.在一密闭气缸中,用一不漏气的滑动活塞隔开,常温时,左边充入$\frac{1}{4}$体积的N2,右边充入$\frac{3}{4}$体积的H2和O2的混合气.若右边气体点燃,反应后恢复到原温度,活塞停留在气缸正中,则原来混合气体中H2和O2的体积比是7:2或4:5(写出计算过程)分析 容器中左右两室压强、温度相同,气体摩尔体积相等,气体的物质的量之比等于其体积之比,开始时左右两室气体体积之比为$\frac{3}{4}$:$\frac{1}{4}$=3:1,其物质的量之比为3:1,假设氢气和氧气的物质的量为3mol,氮气的物质的量为1mol;氢气和氧气反应后恢复到原温,活塞停留在中间,其物质的量之比为1:1,氮气的物质的量不变,为1mol,左室剩余气体物质的量为1mol,剩余气体可能是氢气、也可能是氧气,据此分析解答.
解答 解:容器中左右两室压强、温度相同,气体摩尔体积相等,气体的物质的量之比等于其体积之比,开始时左右两室气体体积之比为$\frac{3}{4}$:$\frac{1}{4}$=3:1,其物质的量之比为3:1,假设氢气和氧气的物质的量为3mol,氮气的物质的量为1mol;氢气和氧气反应后恢复到原温,活塞停留在中间,其物质的量之比为1:1,氮气的物质的量不变,为1mol,左室剩余气体物质的量为1mol,剩余气体可能是氢气、也可能是氧气,
假设剩余气体是氢气,根据2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O知,参加反应的氧气物质的量=$\frac{3mol-1mol}{3}$=$\frac{2}{3}$mol,氢气物质的量为$\frac{7}{3}$mol,二者体积之比=$\frac{7}{3}$mol:$\frac{2}{3}$mol=7:2;
假设剩余气体是氧气,根据2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O知,参加反应的氢气物质的量=$\frac{3mol-1mol}{3}$×2=$\frac{4}{3}$mol,氧气的物质的量为$\frac{5}{3}$mol,则氢气和氧气体积之比=$\frac{4}{3}$mol:$\frac{5}{3}$mol=4:5,
故答案为:7:2或4:5.
点评 本题考查化学方程式的计算,侧重考查分析计算能力,明确左右两室体积之比等于其物质的量之比是解本题关键,再利用氢气和氧气反应关系进行计算,题目难度中等.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案| A. | 常温常压下,11.2 L氧气所含的原子数为NA | |
| B. | 含NA个H2SO4分子的浓硫酸与足量铜反应可制得0.5mol SO2 | |
| C. | 15.6 g Na2O2与过量CO2反应时,转移的电子数为0.2NA | |
| D. | 标准状况下,0.5mol NO和0.5mol O2组成的混合气体,体积约为22.4L |
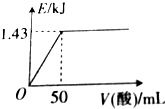 向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )
向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )| A. | 0.5mol•L-1 | B. | 0.4mol•L-1 | C. | 0.25mol•L-1 | D. | 0.1mol•L-1 |
| A. | 是金属还是非金属 | B. | 正负化合价 | ||
| C. | 化学键类型 | D. | 化合物溶解度 |
| A. | C60是一种新型的化合物 | B. | C60的熔点高于石墨 | ||
| C. | C60和石墨都是碳的同素异形体 | D. | C60的摩尔质量为720 |
| A. | 醋酸铵溶液和盐酸反应:CH3COONH4+H+═CH3COOH+NH4+ | |
| B. | 碳酸氢铵溶液和过量氢氧化钠溶液:NH4++OH-═NH3•H2O | |
| C. | 偏铝酸钠溶液和过量盐酸:AlO2-+4H+═Al3++2H2O | |
| D. | 钠跟水反应:Na+2H2O═Na++2OH-+H2↑ |

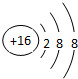 ;D与E能形成一种非极性分子,该分子的结构式为S=C=S;E的单质中,质软有润滑性的是石墨(填写单质名称).
;D与E能形成一种非极性分子,该分子的结构式为S=C=S;E的单质中,质软有润滑性的是石墨(填写单质名称).