题目内容
7.下列离子方程式正确的是( )| A. | 醋酸铵溶液和盐酸反应:CH3COONH4+H+═CH3COOH+NH4+ | |
| B. | 碳酸氢铵溶液和过量氢氧化钠溶液:NH4++OH-═NH3•H2O | |
| C. | 偏铝酸钠溶液和过量盐酸:AlO2-+4H+═Al3++2H2O | |
| D. | 钠跟水反应:Na+2H2O═Na++2OH-+H2↑ |
分析 A.醋酸铵完全电离;
B.漏写碳酸氢根离子与碱的反应;
C.反应生成氯化铝和水;
D.电子、原子不守恒.
解答 解:A.醋酸铵溶液和盐酸反应的离子反应为CH3COO-+H+═CH3COOH,故A错误;
B.碳酸氢铵溶液和过量氢氧化钠溶液的离子反应为HCO3-+NH4++2OH-═NH3•H2O+CO32-+H2O,故B错误;
C.偏铝酸钠溶液和过量盐酸的离子反应为AlO2-+4H+═Al3++2H2O,故C正确;
D.钠跟水反应的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
18.下列有机物不能通过加成反应制取的是( )
| A. | CH3CH2Cl | B. | CH2Cl-CH2Cl | C. | CH3-CH2OH | D. | CH3 Cl |
15.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在密闭容器中充入1 mol N2和3 mol H2,充分反应后生成NH3的分子数目为2NA | |
| B. | 标准状况下,44.8 L氮气所含的共用电子对数目为2NA | |
| C. | 常温常压下,1 mol NaHSO4固体中含有的离子数目为2NA | |
| D. | 1 mol Fe与71 g Cl2充分反应后转移的电子数目为3NA |
2.下列反应的离子方程式正确的是( )
| A. | Cu与浓硝酸反应制NO2:Cu+4HNO3(浓)═Cu2++2NO3-+2NO2↑+2H2O | |
| B. | 向Fe(NO3)2溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| C. | 碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
12. (I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.
(I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.
(1)表中物质②的化学式为HClO4;③的电子式为 .
.
(2)①的稀溶液和⑥的溶液反应的离子方程式为:2H++SO32-═H2O+SO2↑.
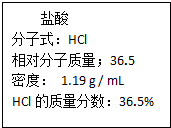
(II)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为:11.9mol/L.
(2)某学生欲用上述浓盐酸和蒸馏水配置500mL 物质的量浓度为0.400mol/L的稀盐酸.
①该学生需要量取16.8mL上述浓盐酸.
②实验中除合适的量筒、烧杯、玻璃棒外还需要的玻璃仪器有500mL容量瓶、胶头滴管.
③在配置过程中,下列实验操作对所配稀盐酸的物质的量浓度有何影响?(填“偏高”、“偏低”或无影响).
a.用量筒量取浓盐酸时俯视读数偏低.
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量蒸馏水偏低.
(3)①假设该同学成功配置了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的氢氧
化钠溶液,该同学需取25mL盐酸.
②该同学用新配置的盐酸中和含0.4g NaOH的氢氧化钠溶液,发现实际所用体积偏小,则可能
的原因是C.
A.盐酸挥发,浓度不足 B.配置过程中未洗涤烧杯和玻璃棒
C.配置溶液定容时,俯视容量瓶刻度线 D.加水超过刻度线,用胶头滴管吸出.
 (I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.
(I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.| 物质类别 | 含氧强酸 | 碱 | 钠盐 |
| 化学式 | ①H2SO4②HClO4 | ③ ④Mg(OH)2 ④Mg(OH)2 | ⑤NaCl ⑥Na2SO3 |
 .
.(2)①的稀溶液和⑥的溶液反应的离子方程式为:2H++SO32-═H2O+SO2↑.
(II)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为:11.9mol/L.
(2)某学生欲用上述浓盐酸和蒸馏水配置500mL 物质的量浓度为0.400mol/L的稀盐酸.
①该学生需要量取16.8mL上述浓盐酸.
②实验中除合适的量筒、烧杯、玻璃棒外还需要的玻璃仪器有500mL容量瓶、胶头滴管.
③在配置过程中,下列实验操作对所配稀盐酸的物质的量浓度有何影响?(填“偏高”、“偏低”或无影响).
a.用量筒量取浓盐酸时俯视读数偏低.
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量蒸馏水偏低.
(3)①假设该同学成功配置了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的氢氧
化钠溶液,该同学需取25mL盐酸.
②该同学用新配置的盐酸中和含0.4g NaOH的氢氧化钠溶液,发现实际所用体积偏小,则可能
的原因是C.
A.盐酸挥发,浓度不足 B.配置过程中未洗涤烧杯和玻璃棒
C.配置溶液定容时,俯视容量瓶刻度线 D.加水超过刻度线,用胶头滴管吸出.
16.对于反应A(g)+3B(g)?2C(g)+2D(g),下列四个数据是在不同条件下测出的该反应的化学反应速率,其中最快的是( )
| A. | v(D)=0.4mol/(L•s) | B. | v(C)=30mol/(L•min) | C. | v(B)=0.4mol/(L•min) | D. | v(A)=0.15mol/(L•s) |
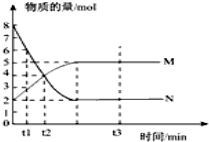 一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图示.
一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图示.
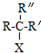 $\stackrel{NaOH/H_{2}O}{→}$
$\stackrel{NaOH/H_{2}O}{→}$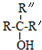 (X为卤素原子,R,R′,R″均为烃基或H原子)
(X为卤素原子,R,R′,R″均为烃基或H原子)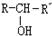 $\stackrel{O_{2}/Ag}{→}$
$\stackrel{O_{2}/Ag}{→}$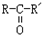 ,
,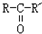 $\stackrel{H_{2}/Ni}{→}$
$\stackrel{H_{2}/Ni}{→}$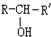
 ; D的结构简式是O=C(CH3)COOH.
; D的结构简式是O=C(CH3)COOH. .
.