题目内容
在2L密闭容器中充有2mol SO2和一定量的O2,发生反应2SO2(g)+O2(g)
2SO3(g).当反应进行到4min时,测得此时SO2为0.4mol,那么反应进行到2min时,密闭容器中SO2物质的量是( )
| 催化剂 |
| △ |
| A、1.6 mol |
| B、1.2 mol |
| C、大于1.6 mol |
| D、小于1.2 mol |
考点:化学平衡建立的过程,化学反应速率的影响因素
专题:化学反应速率专题
分析:先根据反应进行到4min时二氧化硫的物质的量计算出平均反应速率,然后根据此速率计算出2min时消耗的二氧化硫的物质的量和剩余的二氧化硫的物质的量,根据反应时间越小,反应速率越大判断反应进行到2min时,密闭容器中SO2物质的量.
解答:
解:当反应进行到4min时,二氧化硫的平均反应速率为:v=
=
=0.2mol/(L?min),
按照此反应速率,2min时消耗的二氧化硫的物质的量为:n(SO2)=2min×2L×0.2mol/(L?min)=0.8mol,
由于浓度越大,反应速率越快,2min内二氧化硫的浓度大于4min内的浓度,所以2min时消耗的二氧化硫的物质的量大于0.8mol,
反应进行到2min时,密闭容器中SO2物质的量小于(2mol-0.8mol)=1.2mol,
故选D.
| △c |
| △t |
| ||
| 4min |
按照此反应速率,2min时消耗的二氧化硫的物质的量为:n(SO2)=2min×2L×0.2mol/(L?min)=0.8mol,
由于浓度越大,反应速率越快,2min内二氧化硫的浓度大于4min内的浓度,所以2min时消耗的二氧化硫的物质的量大于0.8mol,
反应进行到2min时,密闭容器中SO2物质的量小于(2mol-0.8mol)=1.2mol,
故选D.
点评:本题考查了化学反应速率的计算,题目难度中等,要求掌握化学反应速率的计算方法,本题的关键是理解随着反应的进行,反应物的难度逐渐降低,从而导致反应速率逐渐降低这一客观事实,然后列式计算即可,试题有利于培养学生的分析、理解能力.

练习册系列答案
相关题目
分别取40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和热的测定.下列说法错误的是( )
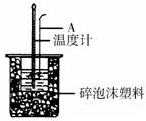

| A、稍过量的氢氧化钠是确保盐酸完全反应 |
| B、仪器A的名称是环形玻璃搅拌棒 |
| C、在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H偏大 |
| D、用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,结果也是正确的 |
四个试管中都装有5mL 0.1mol?L-1 Na2S2O3溶液,分别在不同温度下加入硫酸和一定量水,最先出现浑浊的是( )
| A、20℃,10 mL 0.1mol?L-1硫酸 |
| B、20℃,5 mL 0.1 mol?L-1硫酸和5 mL水 |
| C、30℃,10 mL 1 mol?L-1硫酸 |
| D、30℃,5 mL 1 mol?L-1硫酸和5 mL水 |
下列有关物质性质及应用的说法正确的是( )
| A、过量的铜与浓硝酸反应可生成NO |
| B、Fe在O2中的燃烧产物可用于制红色涂料 |
| C、Na、Cu可以分别用电解冶炼法、热还原法得到 |
| D、Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性 |
 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法不正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法不正确的是( )| A、反应 I2(aq)+I-(aq)?I3-(aq) 的△H<0 |
| B、若反应进行到状态D时,一定有v正>v逆 |
| C、状态A与状态B相比,状态A的c(I2)大 |
| D、若温度为T1,T2反应的平衡常数分别为K1、K2,则K1>K2 |
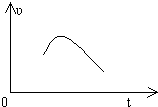 把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是( )
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是( )