题目内容
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外电子数之和为17.请填空:
(1)Y、Z和W是否位于同一周期(填“是”或“否”):
(2)Y是 ,Z是 ,W是 (填元素名称)
(3)X、Y、Z和W可组成一化合物,其原子个数比为8﹕2﹕4﹕1,写出该化合物的化学式: .
(1)Y、Z和W是否位于同一周期(填“是”或“否”):
(2)Y是
(3)X、Y、Z和W可组成一化合物,其原子个数比为8﹕2﹕4﹕1,写出该化合物的化学式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:①元素周期表中,Z与Y相邻,Z与W也相邻则可能位置关系为: 或
或 ;
;
②Y、Z和W三种元素的原子最外电子数之和为17,据①设出Y的最外层电子数为x,用x表示出Z和W的最外层电子数,依据之和为17,列出方程,解x=5,则Y为氮,Z为氧,W为硫,据此解答各小题即可.
 或
或 ;
;②Y、Z和W三种元素的原子最外电子数之和为17,据①设出Y的最外层电子数为x,用x表示出Z和W的最外层电子数,依据之和为17,列出方程,解x=5,则Y为氮,Z为氧,W为硫,据此解答各小题即可.
解答:
解:(1)假设Y、Z、W处于同一周期,根据它们的原子序数依次增大,其最外层电子数分别设为x-1、x、x+1,则x-1+x+x+1=17,x为分数,不合理,假设不成立,故答案为:否;
(2)处于不同周期的Y、Z、W两两相邻,可能出现的位置关系有:

 ,设Y的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,Y、Z、W对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,x为分数,不合理,故答案为:氮;氧;硫;
,设Y的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,Y、Z、W对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,x为分数,不合理,故答案为:氮;氧;硫;
(3)化合物中硫原子与氧原子个数之比为1:4,为硫酸根,化合物中x原子与氮原子个数之比为4:1,且x的原子序数比氮原子小,为铵根离子,所以该化合物为硫酸铵,
其化学式为(NH4)2SO4,故答案为:(NH4)2SO4.
(2)处于不同周期的Y、Z、W两两相邻,可能出现的位置关系有:

 ,设Y的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,Y、Z、W对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,x为分数,不合理,故答案为:氮;氧;硫;
,设Y的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,Y、Z、W对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,x为分数,不合理,故答案为:氮;氧;硫;(3)化合物中硫原子与氧原子个数之比为1:4,为硫酸根,化合物中x原子与氮原子个数之比为4:1,且x的原子序数比氮原子小,为铵根离子,所以该化合物为硫酸铵,
其化学式为(NH4)2SO4,故答案为:(NH4)2SO4.
点评:本题考查学生对元素结构与位置性质关系的利用,难度不大,关键在确定元素Y、Z、W的可能位置,利用最外层电子数之和为17推断.

练习册系列答案
相关题目
在2L密闭容器中充有2mol SO2和一定量的O2,发生反应2SO2(g)+O2(g)
2SO3(g).当反应进行到4min时,测得此时SO2为0.4mol,那么反应进行到2min时,密闭容器中SO2物质的量是( )
| 催化剂 |
| △ |
| A、1.6 mol |
| B、1.2 mol |
| C、大于1.6 mol |
| D、小于1.2 mol |
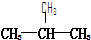
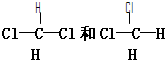 E.CH3CH2CH2CH3和
E.CH3CH2CH2CH3和