题目内容
Na2CO3与NaHCO3的混合物13.7g,与500mL的将盐酸恰好反应,生成气体的质量为6.6g,求该盐酸的物质的量浓度 .
考点:有关混合物反应的计算
专题:
分析:生成的气体是CO2,n(CO2)=
=0.15mol,
设Na2CO3与NaHCO3的物质的量分别是xmol、ymol,
根据C原子守恒、Na2CO3与NaHCO3的质量列方程组为
,解得
,
即Na2CO3与NaHCO3的物质的量分别是0.05mol、0.1mol,二者和盐酸完全反应生成NaCl,根据钠原子、Cl守恒计算盐酸的物质的量浓度.
| 6.6g |
| 44g/mol |
设Na2CO3与NaHCO3的物质的量分别是xmol、ymol,
根据C原子守恒、Na2CO3与NaHCO3的质量列方程组为
|
|
即Na2CO3与NaHCO3的物质的量分别是0.05mol、0.1mol,二者和盐酸完全反应生成NaCl,根据钠原子、Cl守恒计算盐酸的物质的量浓度.
解答:
解:生成的气体是CO2,n(CO2)=
=0.15mol,
设Na2CO3与NaHCO3的物质的量分别是xmol、ymol,
根据C原子守恒、Na2CO3与NaHCO3的质量列方程组为
,解得
,
即Na2CO3与NaHCO3的物质的量分别是0.05mol、0.1mol,二者和盐酸完全反应生成NaCl,
n(NaCl)=2n(Na2CO3)+n(NaHCO3)=0.05mol×2+0.1mol=0.2mol,
根据Cl原子守恒得n(NaCl)=n(HCl)=0.2mol,
所以C(HCl)=
=0.4mol/L,
故答案为:0.4mol/L.
| 6.6g |
| 44g/mol |
设Na2CO3与NaHCO3的物质的量分别是xmol、ymol,
根据C原子守恒、Na2CO3与NaHCO3的质量列方程组为
|
|
即Na2CO3与NaHCO3的物质的量分别是0.05mol、0.1mol,二者和盐酸完全反应生成NaCl,
n(NaCl)=2n(Na2CO3)+n(NaHCO3)=0.05mol×2+0.1mol=0.2mol,
根据Cl原子守恒得n(NaCl)=n(HCl)=0.2mol,
所以C(HCl)=
| 0.2mol |
| 0.5L |
故答案为:0.4mol/L.
点评:本题考查混合物反应的计算,侧重考查学生分析、计算能力,利用原子守恒进行有关计算,题目难度不大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
在2L密闭容器中充有2mol SO2和一定量的O2,发生反应2SO2(g)+O2(g)
2SO3(g).当反应进行到4min时,测得此时SO2为0.4mol,那么反应进行到2min时,密闭容器中SO2物质的量是( )
| 催化剂 |
| △ |
| A、1.6 mol |
| B、1.2 mol |
| C、大于1.6 mol |
| D、小于1.2 mol |
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A、称量时NaOH已经潮解 |
| B、向容量瓶中转移溶液时,容量瓶事先用蒸馏水洗涤过 |
| C、定容时俯视容量瓶的刻度线 |
| D、定容摇匀后,有少量溶液外流 |
下列产品主要成分为二氧化硅的是( )
| A、计算机芯片 | B、太阳能电池 |
| C、水玻璃 | D、光导纤维 |
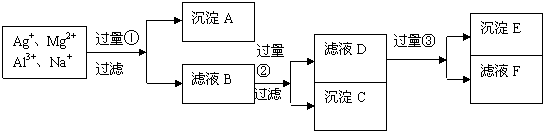
 Ⅰ、阅读、分析下列两个材料:
Ⅰ、阅读、分析下列两个材料: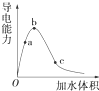 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.