题目内容
分别取40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和热的测定.下列说法错误的是( )
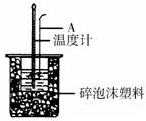

| A、稍过量的氢氧化钠是确保盐酸完全反应 |
| B、仪器A的名称是环形玻璃搅拌棒 |
| C、在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H偏大 |
| D、用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,结果也是正确的 |
考点:中和热的测定
专题:化学反应中的能量变化
分析:A.中和热的测定中,为了使测定结果更准确,一般需要使其中一种反应物过量;
B.根据形状确定仪器名称;
C.中和反应是放热反应;
D.氢氧化钡与硫酸反应生成了硫酸钡沉淀,生成沉淀的过程中会有热量变化,影响测定结果.
B.根据形状确定仪器名称;
C.中和反应是放热反应;
D.氢氧化钡与硫酸反应生成了硫酸钡沉淀,生成沉淀的过程中会有热量变化,影响测定结果.
解答:
解:A.测定中和热时,为了使氢离子或者氢氧根离子完全反应,需要让其中一种反应物稍稍过量,故A正确;
B.仪器A是环形玻璃搅拌棒,故B正确;
C.中和反应是放热反应,温度计上的酸与NaOH溶液反应放热,使温度计读数升高,使测得的中和热偏高,故C正确;
D.硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,该反应中的生成热会影响反应的反应热,所以不能用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,故D错误.
故选D.
B.仪器A是环形玻璃搅拌棒,故B正确;
C.中和反应是放热反应,温度计上的酸与NaOH溶液反应放热,使温度计读数升高,使测得的中和热偏高,故C正确;
D.硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,该反应中的生成热会影响反应的反应热,所以不能用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,故D错误.
故选D.
点评:本题考查学生有关中和热的测定知识,注意对中和热概念的理解,难度不大,在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
分离下列三组混合物依次采取的方法正确的是:①氯化钠溶液和鸡蛋清 ②植物油和氯化钠溶液 ③碳酸钙和氯化钙的溶液( )
| A、渗析、蒸馏、萃取 |
| B、渗析、分液、过滤 |
| C、分液、过滤、加热升华 |
| D、蒸馏、萃取、分液 |
在2L密闭容器中充有2mol SO2和一定量的O2,发生反应2SO2(g)+O2(g)
2SO3(g).当反应进行到4min时,测得此时SO2为0.4mol,那么反应进行到2min时,密闭容器中SO2物质的量是( )
| 催化剂 |
| △ |
| A、1.6 mol |
| B、1.2 mol |
| C、大于1.6 mol |
| D、小于1.2 mol |


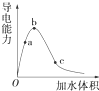 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.