题目内容
4.在元素Fe单质及其化合物变化中,下列说法正确的是( )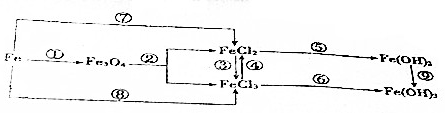
| A. | ③反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 钢铁腐蚀时,负极发生的反应是Fe-3e-═Fe3+ | |
| C. | 以Fe为电极,电解饱和NaCl溶液,阳极反应式为2Cl--2e-═Cl2↑ | |
| D. | FeCl2溶液中混有少量FeCl3,可以加入Fe、Cu等金属除去FeCl3 |
分析 A.亚铁离子具有还原性被氯气氧化生成铁离子;
B.铁发生电化腐蚀生成亚铁离子;
C.铁为电极为活性电极,铁失电子被氧化;
D.加入铜和氯化铁反应生成氯化亚铁和氯化铜,会引入新的杂质.
解答 解:A.③反应是氯气氧化亚铁离子为铁离子,反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-,故A正确;
B.钢铁腐蚀时,负极发生的反应是Fe-2e-═Fe2+,故B错误;
C.以Fe为电极,电解饱和NaCl溶液,阳极反应式为Fe-2e-═Fe2+,故C错误;
D.FeCl2溶液中混有少量FeCl3,可以加入Fe除去FeCl3,加入铜发生反应2Fe3++Cu=Cu2++2Fe2+,引入铜离子,故D错误;
故选A.
点评 本题考查了铁及其化合物性质、原电池和电解池原理、电极反应书写等,掌握基础是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.在一定温度下,将气体X与气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
| t∕min | 2 | 4 | 7 | 9 |
| n(Y)∕mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前4min的平均反应速率υ(Z)=0.0125 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正) | |
| C. | 该温度下此反应的平衡常数K=1.44 | |
| D. | 其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大 |
12.常温下,NaHCO3溶液呈弱碱性.下列关于0.10mol•L-1NaHCO3溶液的说法正确的是( )
| A. | 加水稀释,HCO3-?H++CO32-平衡右移,溶液中氢离子浓度减小 | |
| B. | 加水稀释后,碳酸氢根离子水解平衡向右移动,溶液中氢氧根离子浓度减小 | |
| C. | 加水稀释后,n(H+)与n(OH-)的乘积不变 | |
| D. | 温度升高,c(HCO3-)增大 |
9.对已经达到衡的下列反应;2X(g)+Y(g)?2Z(g)减小压强时,对反应产生的影响是( )
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 | |
| B. | 逆反应速率减小,正反应速率增大,平衡向正反应方向移动 | |
| C. | 正、逆速率都减小,平衡向逆反应方向移动 | |
| D. | 正、逆速率都增大,平衡向正反应方向移动 |
16.下列叙述中中正确的是( )
| A. | 某溶液加入足量NaOH溶液,加热产生碱性的气体,溶液一定是铵盐溶液 | |
| B. | 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 | |
| C. | NO2和SO2都能使湿润的蓝色的石蕊试纸变红后褪色 | |
| D. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液可能有可能有SO32- |
16.下列有关叙述正确的是( )
| A. | BaCO3难溶于水中,可用作X射线透视肠胃的内服药 | |
| B. | 中国在建的第二艘航母中使用的碳纤维是一种新型的有机高分子材料 | |
| C. | 酸碱指示剂变色、煤的液化、蛋白质的颜色反应、海水提取溴、焰色反应都涉及化学变化 | |
| D. | 获得2015年诺贝尔医学奖的屠呦呦用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理 |
17.已知K2O、K2O2、KO2的名称依次是氧化钾、过氧化钾、超氧化钾.推测BaO2的名称为( )
| A. | 氧化钡 | B. | 过氧化钡 | C. | 超氧化钡 | D. | 无法确定 |
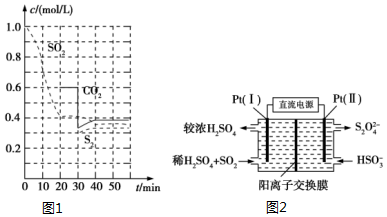 SO2直接排放会对环境造成危害.SO2的尾气处理通常有以下几种方法:
SO2直接排放会对环境造成危害.SO2的尾气处理通常有以下几种方法: