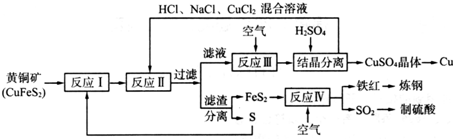
题目内容
18. 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:(1)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1mol•L?1的氨水中加入少量的NH4Cl固体,溶液的pH降低(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度增大(填“增大”或“减小”).
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为NH4NO3$\stackrel{△}{?}$N2O+2H2O,平衡常数表达式为K=c(N2O)×c2(H2O);若有1mol硝酸铵完全分解,转移的电子数为4mol.
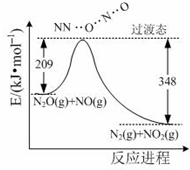
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,该反应的热化学方程式为:
N2O(g)+NO(g)═N2(g)+NO2(g)△H=-139kJ•mol?1.
分析 (1)一水合氨为弱碱,溶于水存在部分电离,依据化学平衡原理解释加入NH4Cl固体以及明矾后平衡移动方向以及pH的变化;
(2)依据所给的反应物和产物,结合元素守恒书写方程式即可,依据反应书写平衡常数表达式,依据氧化还原反应得失电子守恒计算转移电子数;
(3)由图可知,此反应为放热反应,热效应=(209-348)kJ•mol-1.
解答 解:(1)一水合氨为弱碱,在水溶液中存在部分电离,电离出氢氧根离子使溶液显碱性,方程式为:NH3•H2O?NH4++OH-,向氨水中加入少量NH4Cl固体,铵根浓度增大,平衡左移,即氢氧根浓度减小,pH值降低,加入少量明矾,明矾电离出的铝离子结合氢氧根生成氢氧化铝,促进氨水的电离,铵根浓度增大,
故答案为:NH3•H2O?NH4++OH-;降低;增大;
(2)硝酸铵分解生成N2O和H2O,达到平衡,说明为可逆反应,化学反应方程式为:NH4NO3$\stackrel{△}{?}$N2O+2H2O,250℃时,水为气体状态,故平衡常数K=c(N2O)×c2(H2O),NH4NO3中NH4+的N元素化合价为-3价,NO3-中的N元素的化合价为+5价,反应后N元素的化合价为+1价,发生归中反应,N元素由-3价升高为+1价,此反应中每分解1mol硝酸铵,转移电子数为4mol,
故答案为:NH4NO3$\stackrel{△}{?}$N2O+2H2O;K=c(N2O)×c2(H2O);4;
(3)由图可知,此反应反应物总能量高于生成物,且△H=209-348=-139kJ•mol-1,则热化学方程式为:N2O(g)+NO(g)═N2(g)+NO2(g)△H=-139kJ•mol?1;
故答案为:N2O(g)+NO(g)═N2(g)+NO2(g)△H=-139kJ•mol?1.
点评 本题主要考查的是弱电解质的电离以及电离平衡的影响因素,还考查了氧化还原反应原理以及化学反应的热效应计算,难度不大,侧重于考查学生的分析能力和计算能力.

 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.(1)溴的价电子排布式为4s24p5;PCl3的空间构型为三角锥形.
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘.
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
A. HCl B.HF C. SO2 D. SCl2
(5)已知COCl2为平面形,则COCl2中心碳原子的杂化轨道类型为sp2杂化,写出CO的等电子体的微粒N2(写出1个).
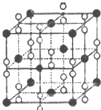
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρg•cm-3,则晶胞离得最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{4×72}{{ρ•N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA).
| A. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | |
| B. | Mg2+的结构示意图: | |
| C. | CO2的电子式: | |
| D. | 熔融状态下硫酸氢钾的电离方程式:KHSO4$\frac{\underline{\;熔融\;}}{\;}$K++H++SO42- |
| A. | 铁粉撒入稀硫酸中2Fe+6H+→2Fe3++3H2↑ | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O→AlO2-+4NH4++2H2O | |
| C. | 把金属钠放入冷水中:Na+H2O→Na++OH-+H2↑ | |
| D. | 用氢氧化钠溶液除去铝表面的氧化铝:Al2O3+2OH-→2AlO2-+H2O |
| A. | 向KCl溶液中滴加几滴酚酞试液,溶液颜色变红 | |
| B. | 向KI溶液中通入适量Cl2后,溶液颜色变深 | |
| C. | 溴水与NaCl溶液混合时,会发生置换反应 | |
| D. | NaCl溶液在空气中会被氧化,故需要密封保存 |
| A. | 除去氯化钠溶液中的泥沙--蒸发结晶 | |
| B. | 分离水和乙醇--蒸馏 | |
| C. | 用四氯化碳提取溴水中的溴单质--萃取 | |
| D. | 分离汽油和水--分液 |
| A. | 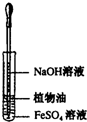 观察Fe(OH)2的生成 | B. | 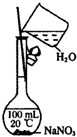 配制一定量浓度的NaNO3的溶液 | ||
| C. | 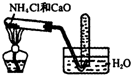 实验室制取氨气 | D. | 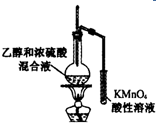 验证乙烯的生成 |
| A. | 二氧化硅能与水反应 | |
| B. | 用二氧化硅制取单质硅,当生成2.24 L(标准状况下)气体时,得到2.8g硅 | |
| C. | 二氧化硅属于传统的无机非金属材料 | |
| D. | 二氧化硅不能与碳酸钠溶液发生反应,但在高温下能与碳酸钠固体发生反应 |