题目内容
17. 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.(1)溴的价电子排布式为4s24p5;PCl3的空间构型为三角锥形.
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘.
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
A. HCl B.HF C. SO2 D. SCl2
(5)已知COCl2为平面形,则COCl2中心碳原子的杂化轨道类型为sp2杂化,写出CO的等电子体的微粒N2(写出1个).
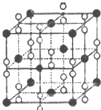
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρg•cm-3,则晶胞离得最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{4×72}{{ρ•N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA).
分析 (1)溴处于第四周期ⅦA族;PCl3中P原子孤电子对数=$\frac{5-1×3}{2}$=1,价层电子对数=3+1=4;
(2)在离子晶体中离子半径越小、离子所带电荷越高,晶格能越大;
(3)第一电离能是指原子失去一个电子所需的能量,第一电离能越小,就越容易失去一个电子;
(4)s能级与p能级电子形成的共价键为s-pσ键,p能级电子之间形成双键、三键中含有p-pπ键;
(5)COCl2为平面形,其结构式是 ,C原子的杂化轨道数目为3;等电子体是具有相同的价电子数和相同原子数的微粒;
,C原子的杂化轨道数目为3;等电子体是具有相同的价电子数和相同原子数的微粒;
(6)根据均摊法确定晶胞中各种原子的个数,再确定其化学式,计算晶胞质量,结合密度确定晶胞的体积,进而求得晶胞的边长,两个离得最近的钙是位于顶点和面心上的,它们的距离为晶胞边长的$\frac{\sqrt{2}}{2}$.
解答 解:(1)溴处于第四周期ⅦA族,价电子排布式为4s24p5;PCl3中P原子孤电子对数=$\frac{5-1×3}{2}$=1,价层电子对数=3+1=4,分子空间构型为三角锥形,
故答案为:4s24p5;三角锥形;
(2)CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,由于氯离子的半径小于碘离子,所以CsCl的晶格能大于CsI的晶格能,按反应CsICl2=CsCl+ICl进行,
故选:A;
(3)I的第一电离能越小,碘更容易形成较稳定的单核阳离子,故答案为:碘;
(4)A. HCl中为单键,存在s-pσ键,
B.HF中为单键,存在s-pσ键,
C. SO2中含有双键,存在p-pπ键,
D. SCl2中为单键,存在p-pσ键,
故答案为:D;
(5)COCl2为平面形,其结构式是 ,C原子的杂化轨道数目为3,杂化类型为sp2杂化;CO的等电子体的微粒为:N2等,
,C原子的杂化轨道数目为3,杂化类型为sp2杂化;CO的等电子体的微粒为:N2等,
故答案为:sp2杂化;N2;
(6)晶胞中钙离子的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,过氧离子的个数为12×$\frac{1}{4}$+1=4,故其化学式为CaO2,晶胞质量为4×$\frac{72}{{N}_{A}}$g,设晶胞的边长为acm,则(a cm)3×ρg•cm-3=4×$\frac{72}{{N}_{A}}$g,故a=$\root{3}{\frac{4×72}{{ρ•N}_{A}}}$,两个离得最近的钙是位于顶点和面心上的,它们的距离为晶胞边长的$\frac{\sqrt{2}}{2}$,即为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{4×72}{{ρ•N}_{A}}}$cm,
故答案为:CaO2;$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{4×72}{{ρ•N}_{A}}}$cm.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、晶格能、原子杂化轨道、等电子体、晶胞的计算等知识点,中等难度,解题时注意基础知识的灵活运用.

 智慧小复习系列答案
智慧小复习系列答案| A. | 乙酸(CH3COOH) | B. | 氨基乙酸(H2N-CH2-COOH) | ||
| C. | 尿素(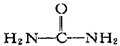 ) ) | D. | 硝化甘油(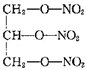 ) ) |
| A. | 氨气通入醋酸中:CH3COOH+NH3═CH3COO-+NH4+ | |
| B. | 向碳酸氢镁溶液中加过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ | |
| C. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
| A. | 煤炭经过干馏,石油经分馏、裂化、裂解化工处理,可获得清洁能源和重要的化工原料 | |
| B. | 比能量低而笨重的铅蓄电池使用时电压不稳定,所以有被其他新型电池取代的趋势 | |
| C. | 玛瑙饰品的主要成分与建筑材料砂子相同 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料单晶硅也可以制备电脑芯片 |
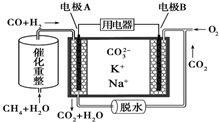
| A. | 放电时负极有CO2生成 | |
| B. | 正极反应为O2+2CO2+4e-═2CO32- | |
| C. | 反应CH4+H2O$→_{△}^{催化剂}$3H2+CO,每消耗1molCH4转移6mol 电子 | |
| D. | 该电池可在常温或高温时进行工作,对环境具有较强的适应性 |
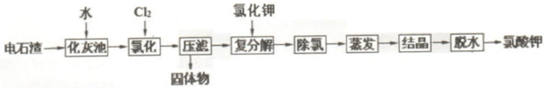
已知:①几种物质溶解度与温度的关系
| 温度/ | 0 | 10 | 20 | 30 | 40 |
| S(CaCl2)/g | 59.5 | 64.7 | 74.5 | 100 | 128 |
| S[Ca(ClO3)2]/g | 209 | ||||
| S(KClO3)/g | 3.3 | 5.2 | 7.3 | 10.2 | 13.9 |
(1)某导电塑料是以乙炔为单体加聚合成,其化学为
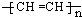 .
.(2)化灰池中为加快水浸的速度,常采取的措施搅拌、加热.
(3)为除去Fe/Al 等杂质,氯化过程中需要控制溶液 pH为6-7.
(4)氯化过程的温度控制在 75~80℃,该过程主要反应的离子方程式为6Cl2+6Ca(OH)2=6Ca2++10Cl-+2ClO3-. 温度过低会发生副反应,产生的副产物为Ca(ClO)2(写化学式).
(5)复分解反应中,常控制温度为 20℃,加入KCl 发生的反应的方程式Ca(ClO3)2+2KCl=CaCl2+2KClO3+6H2O.
(6)通常用石墨电极电解 KClO 溶液制备 KClO3,则阳极的电极反应方程式为ClO--4e-+2H2O=ClO3-+4H+.
脱水过程实现固液分离,工业常用的设备是C
A.蒸馏塔 B.反应釜 C.离心机 D.交换器
(7)现代工艺氯化时通入O2做氧化剂提高效率,其氯化的化学方程式为2Ca(OH)2+2Cl2+5O2=2Ca(ClO3)2+2H2O.
| A. | 金属元素在不同的化合物中化合价均相同 | |
| B. | 所有合金都只含有金属元素 | |
| C. | 可利用铝热反应冶炼单质镁 | |
| D. | 镁合金的硬度和强度均高于纯镁 |

 碱性条件下氧化为
碱性条件下氧化为 .
.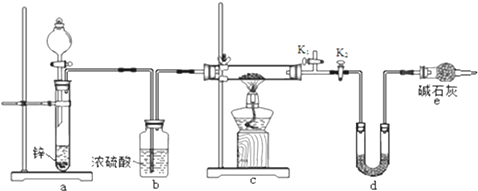
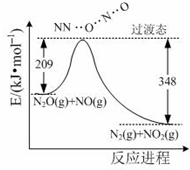 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题: