题目内容
13.下列说法中,正确的是( )| A. | 向KCl溶液中滴加几滴酚酞试液,溶液颜色变红 | |
| B. | 向KI溶液中通入适量Cl2后,溶液颜色变深 | |
| C. | 溴水与NaCl溶液混合时,会发生置换反应 | |
| D. | NaCl溶液在空气中会被氧化,故需要密封保存 |
分析 A.酚酞在碱性溶液中显红色;
B.依据氯气具有强的氧化性,能够与碘化钾反应生成碘单质解答;
C.溴单质的氧化性弱于氯气;
D.NaCl溶液在空气中能稳定存在.
解答 解:A.KCl溶液为中性,加入酚酞不显色,故A错误;
B.氯气具有强的氧化性,能够与碘化钾反应生成碘单质,碘水颜色为红褐色,故B正确;
C.溴水与NaCl溶液混合时,溴单质的氧化性弱于氯气,二者不会发生置换反应,故C错误;
D.NaCl溶液在空气中能稳定存在,只会伴随着水分的蒸发,不会被氧化,故无需密封保存,故D错误;
故选B.
点评 本题考查了卤素单质的性质,熟悉相关物质的性质,注意单质的氧化性顺序以及离子的还原性顺序的应用是关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.一种熔融碳酸盐燃料电池工作原理如图所示.则下列推断错误的是( )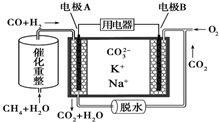

| A. | 放电时负极有CO2生成 | |
| B. | 正极反应为O2+2CO2+4e-═2CO32- | |
| C. | 反应CH4+H2O$→_{△}^{催化剂}$3H2+CO,每消耗1molCH4转移6mol 电子 | |
| D. | 该电池可在常温或高温时进行工作,对环境具有较强的适应性 |
4.下列过程中,不属于氮的固定的是( )
| A. | 闪电时,N2变为NO | B. | NO被空气中O2氧化为NO2 | ||
| C. | 工业上,用N2合成氨 | D. | 豆科植物根瘤菌把N2变成NH3 |
1.下列说法正确的是( )
| A. | 体系有自发地向混乱度增加(即熵增)的方向转变的倾向,这是自然界的普遍规律 | |
| B. | 判断过程的自发性能确定过程能否发生和过程发生的速率 | |
| C. | 其它条件相同时,增大反应物浓度能使分子获得能量,活化分子百分数提高,反应速率增大 | |
| D. | 催化剂不影响反应活化能,从而只影响反应速率,不影响化学平衡 |
8.有CuO和Fe2O3组成的混合物ag,向其中加入2mol/L的硫酸50mL,恰好完全反应.如将2ag该混合物在足量H2中加热,使其充分反应,冷却后剩余固体的质量为( )
| A. | (2a-1.6)g | B. | 2(a-1.6)g | C. | (a-1.6)g | D. | 3.2g |
2.下列说法错误的是( )
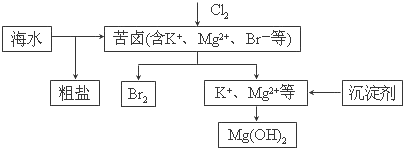

| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂和重结晶等过程提纯 | |
| C. | 工业生产中常选用NaOH作为沉淀剂 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其氧化吸收 |
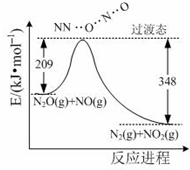 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
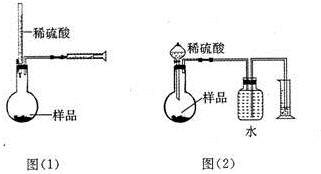 为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.
为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.