题目内容
18.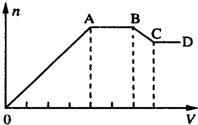 某溶液中,可能含有下表所列离子中的某几种:
某溶液中,可能含有下表所列离子中的某几种:| 阳离子 | Al3+、Mg2+、NH4+、Na+ |
| 阴离子 | CO32-、SiO32-、[Al(OH)4]-、Cl- |
(1)若X是NaOH溶液,原溶液中一定含有的阴离子有Cl-;BC段反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]-或Al(OH)3+OH-=AlO2?+H2O.
(2)若X是盐酸,则原溶液中一定含有的金属阳离子是Na+;AB段发生反应的总离子方程式为CO32-+2H+=H2O+CO2↑;OA段生成沉淀的物质的量之比为11:2.
分析 (1)若X是氢氧化钠,向溶液中加氢氧化钠溶液,先生成沉淀,当AB段时,沉淀的量不变化,氢氧化钠和铵根离子反应生成氨气;当BC段时沉淀的质量减少,部分沉淀和氢氧化钠反应,部分沉淀不反应,说明溶液中有Al3+、Mg2+,则溶液中不含CO32-、SiO32-、[Al(OH)4]-,所以溶液中含有的阴离子是Cl-;
(2)如果X是盐酸,向溶液中加盐酸,先生成沉淀,则溶液中可能含SiO32-、AlO2-或两者中的一种,即生成的沉淀为H2SiO3、Al(OH)3或两者中的一种,则溶液中不含Al3+、Mg2+;当AB段时,沉淀的量不变化,发生的是盐酸和碳酸根离子反应生成气体;当BC段时沉淀的质量减少,即部分沉淀和盐酸反应,部分沉淀和盐酸不反应,说明生成的沉淀既有H2SiO3又有Al(OH)3,原溶液中有SiO32-、[Al(OH)4]-,弱酸根离子和铵根离子能双水解,所以溶液中不含NH4+,含有的阳离子是Na+,
根据以上分析进行解答.
解答 解:(1)若X是NaOH,向溶液中加氢氧化钠溶液,先生成沉淀,当AB段时,沉淀的量不变化,氢氧化钠和铵根离子反应生成氨气;当BC段时沉淀的质量减少,部分沉淀和氢氧化钠反应,部分沉淀不反应,说明溶液中有Al3+、Mg2+,则溶液中不含CO32-、SiO32-、[Al(OH)4]-,所以溶液中含有的阴离子是Cl-;
BC段氢氧化铝溶解,反应的离子方程式为:Al(OH)3+OH-=[Al(OH)4]-或Al(OH)3+OH-=AlO2?+H2O,
故答案为:Cl-;Al(OH)3+OH-=[Al(OH)4]-或Al(OH)3+OH-=AlO2?+H2O;
(2)如果X是盐酸,向溶液中加盐酸,先生成沉淀,则溶液中可能含SiO32-、AlO2-或两者中的一种,即生成的沉淀为H2SiO3、Al(OH)3或两者中的一种,则溶液中不含Al3+、Mg2+;当AB段时,沉淀的量不变化,发生的是盐酸和碳酸根离子反应生成气体;当BC段时沉淀的质量减少,即部分沉淀和盐酸反应,部分沉淀和盐酸不反应,说明生成的沉淀既有H2SiO3又有Al(OH)3,原溶液中有SiO32-、[Al(OH)4]-,弱酸根离子和铵根离子能双水解,所以溶液中不含NH4+,含有的阳离子是Na+;
AB段碳酸根离子与氢离子反应生成二氧化碳气体,发生反应的总离子方程式为:CO32-+2H+=H2O+CO2↑;
根据图象可知,生成硅酸、氢氧化铝沉淀消耗HCl的物质的量与溶解氢氧化铝消耗HCl的物质的量之比为4:1,设溶解氢氧化铝消耗盐酸的物质的量为1mol,则氢氧化铝的物质的量为$\frac{1mol}{3}$,生成氢氧化铝沉淀消耗HCl的物质的量为:$\frac{1mol}{3}$,则生成硅酸沉淀消耗HCl的物质的量为:4mol-$\frac{1mol}{3}$=$\frac{11}{3}$,所以生成硅酸的物质的量为:$\frac{\frac{11}{3}mol}{2}$=$\frac{11}{6}$mol,故OA段生成沉淀的物质的量之比为n(H2SiO3):n[Al(OH)3]=$\frac{11}{6}$mol:$\frac{1mol}{3}$=11:2,
故答案为:Na+;CO32-+2H+=H2O+CO2↑; n(H2SiO3):n[Al(OH)3]=11:2.
点评 本题考查了混合物反应的计算、离子的检验方法,题目难度中等,明确发生反应原理为解答关键,注意正确分析图象曲线变化,试题培养了学生的分析能力及化学计算能力.

| A. | C2H4O | B. | C2H5OH | C. | CH3CHO | D. | CH3COOH |
| A. | 次氯酸的电子式: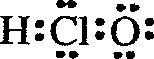 | B. | 硫原子的价电子排布式:3s23p4 | ||
| C. | 氮化硅的分子式:Si4N3 | D. | N原子的电子排布图为: |
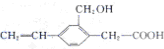
| A. | 该有机化合物的分子式为C11H10O3 | |
| B. | 该有机化合物能发生取代反应、加成反应和加聚反应 | |
| C. | 1mol该有机化合物分别消耗Na、NaOH和NaHCO3的物质的量之比为2:2:1 | |
| D. | 该有机化合物与 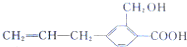 互为同系物 互为同系物 |
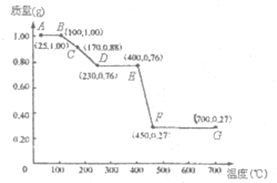 如图是1.00g MgC2O4•nH2O晶体放在坩埚里从25℃徐徐加热至700℃时,所得同体产物的质量(m)随温度(t)变化的关系曲线.(已知100℃以上才会逐渐失去结晶水,并约在230℃时完全失去结晶水)
如图是1.00g MgC2O4•nH2O晶体放在坩埚里从25℃徐徐加热至700℃时,所得同体产物的质量(m)随温度(t)变化的关系曲线.(已知100℃以上才会逐渐失去结晶水,并约在230℃时完全失去结晶水)
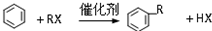 A具有和苯相似的性质.
A具有和苯相似的性质. 2HCHO+2H2O;
2HCHO+2H2O;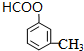 、
、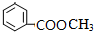 ;
;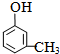 .
.