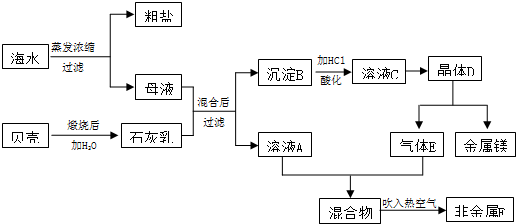
题目内容
12.A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.请回答:(1)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物发生反应,完全反应后消耗后者的物质的量为8mol.
(2)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为HS-+OH-=S2-+H2O.
(3)单质B的燃烧热a kJ/mol.由B、C二种元素组成的化合物BC14 g完全燃烧放出b kJ热量,写出单质B和单质C反应生成BC的热化学方程式:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-(a-2b) kJ•mol-1.
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2.在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1 mol A2C和1 mol BC、2 mol A2C和2 mol BC.一定条件下,充分反应后分别达到平衡(两容器温度相等).下列说法正确的是AB.
A.达到平衡所需要的时间:Ⅰ>Ⅱ
B.达到平衡后A2C的转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>Ⅱ
D.达到平衡后A2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ
F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式是Al-3e-+4OH-═AlO2-+2H2O.
分析 A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,F元素的最外层电子数是次外层电子数的0.75倍,则次外层电子为8,最外层电子数为6,则F为S元素,C、F是同一主族元素,则C为O元素;B元素的最外层电子数是内层电子数的2倍,原子只能有2个电子层,内层电子数为2,则最外层电子数为4,所以B为C元素;E元素的最外层电子数等于其电子层数,则为第三周期第ⅢA族,即E为Al元素;A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,则A、D的质子数相差10,故A为H元素,D为Na元素,据此解答.
解答 解:A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,F元素的最外层电子数是次外层电子数的0.75倍,则次外层电子为8,最外层电子数为6,则F为S元素,C、F是同一主族元素,则C为O元素;B元素的最外层电子数是内层电子数的2倍,原子只能有2个电子层,内层电子数为2,则最外层电子数为4,所以B为C元素;E元素的最外层电子数等于其电子层数,则为第三周期第ⅢA族,即E为Al元素;A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,则A、D的质子数相差10,故A为H元素,D为Na元素.
(1)E、F二种元素组成的化合物为Al2S3,由A、C、D三种元素组成的化合物为NaOH,Al2S3先发生双水解反应生成2 molAl(OH)3和3 molH2S,再与氢氧化钠溶液反应生成NaAlO2、Na2SO3,由原子守恒可知1molAl2S3消耗NaOH为1mol×2+3mol×2=8mol,
故答案为:8mol;
(2)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲为HS-、乙为OH-,甲与乙反应的离子方程式为:HS-+OH-=S2-+H2O,
故答案为:HS-+OH-=S2-+H2O;
(3)由题意可得热化学方程式:①C(s)+O2(g)═CO2(g)△H=-a kJ•mol-1
②CO2(g)═CO(g)+$\frac{1}{2}$O2(g)△H=+2b kJ•mol-1
由盖斯定律知,①+②可得:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-(a-2b) kJ•mol-1,
故答案为:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-(a-2b) kJ•mol-1;
(4)反应方程式为:CO(g)+H2O(g)═CO2(g)+H2(g),该反应前后的气体系数相等,因此,在容器体积相同时,按成倍的不同的起始量加入反应物,平衡不受影响,反应程度相同,为等效平衡,但速率不同,浓度大时速率快,则:
A.反应速率Ⅰ<Ⅱ,故达到平衡所需要的时间:Ⅰ>Ⅱ,故A正确;
B.反应程度相同,Ⅰ、Ⅱ中转化率相等,故B正确;
C.转化率相等,则达到平衡后BC的物质的量:Ⅰ<Ⅱ,故C错误;
D.二者为等效平衡,平衡后A2的体积分数相等,故D错误;
E.Ⅱ中参加反应的反应物的量更大,故达到平衡后吸收或放出的热量:Ⅰ<Ⅱ,故E错误;
F.达到平衡后体系中同种组分的含量相等,则平均相对分子质量相等,故F错误,
故选:AB;
(5)用碳元素的单质与Al制成电极浸入由NaOH的溶液中构成电池,总反应为2Al+2NaOH+2H2O═2NaA1O2+3H2↑,可知负极的电极反应式Al-3e-+4OH-═AlO2-+2H2O,
故答案为:Al-3e-+4OH-═AlO2-+2H2O.
点评 本题考查位置结构性质的关系、原电池原理、热化学方程式书写、化学平衡移动、化学计算等,综合性较强,元素的推断是解答本题的关键,(1)中注意硫化铝在水中发生的双水解反应,难度中等.

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案| A. | 杀死水果周围的细菌,防止水果霉变 | |
| B. | 吸收水果周围的氧气,防止水果腐烂 | |
| C. | 吸收水果产生的乙烯,防止水果早熟 | |
| D. | 氧化性较强,催熟水果 |
①NH4NO3晶体; ②浓H2SO4; ③NaOH粉末;
④NaCl晶体 ⑤Na2O2固体; ⑥生石灰.

| A. | ①②④⑤ | B. | ①②③ | C. | ③④⑤ | D. | ②③⑤⑥ |
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.8 | 2.4 | 0.4 | 放出热量:Q |
| A. | 容器①、②中反应的平衡常数相等,平衡时氮气的转化率相等 | |
| B. | 平衡时,两个容器中NH3 的体积分数均为1/8 | |
| C. | 容器②中达平衡时放出的热量Q=4.63 kJ | |
| D. | 若容器①改为恒压体系,充入0.25 L He,则平衡时放出的热量大于23.15 kJ |
| A. | 加入Al能放出H2的溶液中:ClO-、HCO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、NH${\;}_{4}^{+}$ | |
| B. | pH=2的溶液中:Fe2+、Na+、Mg2+、NO${\;}_{3}^{-}$ | |
| C. | 能使KSCN溶液变红的溶液中:Na+、I-、NO${\;}_{3}^{-}$、HCO${\;}_{3}^{-}$ | |
| D. | 由水电离出的c(OH-)=1.0×10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、Br- |
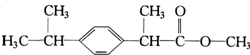 某种药物主要成分X的分子结构如图,关于有机物X的说法中错误的是( )
某种药物主要成分X的分子结构如图,关于有机物X的说法中错误的是( )①X难溶于水,易溶于有机溶剂
②X能跟溴水反应
③X能使酸性高锰酸钾溶液褪色
④X的水解产物能发生消去反应.
| A. | ①④ | B. | ②④ | C. | ②③ | D. | ①② |
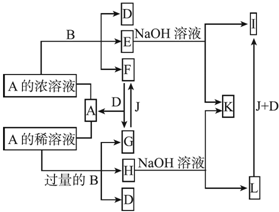
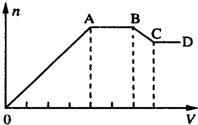 某溶液中,可能含有下表所列离子中的某几种:
某溶液中,可能含有下表所列离子中的某几种:| 阳离子 | Al3+、Mg2+、NH4+、Na+ |
| 阴离子 | CO32-、SiO32-、[Al(OH)4]-、Cl- |
(1)若X是NaOH溶液,原溶液中一定含有的阴离子有Cl-;BC段反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]-或Al(OH)3+OH-=AlO2?+H2O.
(2)若X是盐酸,则原溶液中一定含有的金属阳离子是Na+;AB段发生反应的总离子方程式为CO32-+2H+=H2O+CO2↑;OA段生成沉淀的物质的量之比为11:2.