题目内容
 在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(2)n3
(3)若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是
(4)在(3)中条件下达到平衡后四氧化二氮的转化率为
(5)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2?N2O4的平衡常数将
(6)达到平衡后,如向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,则平衡将
考点:反应速率的定量表示方法,化学平衡常数的含义,化学平衡的影响因素,物质的量或浓度随时间的变化曲线
专题:化学平衡专题,化学反应速率专题
分析:(1)根据表中数据计算四氧化二氮的反应速率,根据速率之比等于化学计量数之比计算二氧化氮的反应速率;
(2)反应达到60s时达到化学平衡状态,二氧化氮的物质的量不再变化,计算出平衡时各物质的浓度,根据平衡常数的计算公式计算该反应的平衡常数;
(3)根据等效平衡原理计算;根据等效平衡计算出平衡时四氧化二氮的物质的量浓度,以此画出图象;
(4)在(3)中条件下达到平衡后四氧化二氮的物质的量为0.08mol,与充入二氧化氮为相同平衡状态;
(5)升高温度,气体颜色会变深,说明升高温度平衡向左移动;
(6)根据稀有气体不影响化学平衡及扩大体积,生成物与反应物的浓度商增大进行判断.
(2)反应达到60s时达到化学平衡状态,二氧化氮的物质的量不再变化,计算出平衡时各物质的浓度,根据平衡常数的计算公式计算该反应的平衡常数;
(3)根据等效平衡原理计算;根据等效平衡计算出平衡时四氧化二氮的物质的量浓度,以此画出图象;
(4)在(3)中条件下达到平衡后四氧化二氮的物质的量为0.08mol,与充入二氧化氮为相同平衡状态;
(5)升高温度,气体颜色会变深,说明升高温度平衡向左移动;
(6)根据稀有气体不影响化学平衡及扩大体积,生成物与反应物的浓度商增大进行判断.
解答:
解:(1)由表中数据可知,从反应开始直至20s时,v(N2O4)=
=0.075mol?L-1?min-1,则v(NO2)=2v(N2O4)=2×0.075mol?L-1?min-1=0.015mol?L-1?min-1,
故答案为:0.15;
(2)反应达到60s时达到化学平衡状态,二氧化氮的物质的量不再变化,所以n3=n4,
2NO2 ?N2O4
初始:0.4mol 0
转化:0.16mol 0.08mol
平衡:0.24mol 0.08mol
则平衡时的浓度分别为:c(N2O4)=
=0.04mol/L,c(NO2)=
=0.12mol/L,
k=
=
=2.8,
故答案为:=;2.8;
(3)根据反应 2NO2 ?N2O4可知,0.4molNO2与0.2molN2O4相当,若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是:
=0.1mol/L;从放入N2O4到平衡时需要80s,初始加入的N2O4为0.2mol,物质的量浓度为0.1mol/L,二氧化氮浓度为0;终点N2O4的浓度为0.04mol/L,终点二氧化氮浓度为0.12mol/L,图象可取20s,40s,80s等几个点用平滑曲线来连接,该条件下此反应中N2O4和NO2的浓度随时间变化的曲线为: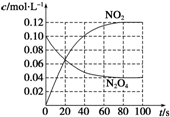 ,
,
故答案为:0.1mol/L; ;
;
(4)根据等效平衡,在(3)中条件下达到平衡后四氧化二氮的物质的量为0.08mol,与充入二氧化氮为相同平衡状态,则反应消耗的四氧化二氮的物质的量为0.2mol-0.08mol=0.12mol,同时生成的二氧化氮的物质的量为:0.24mol,所以达到平衡后四氧化二氮的转化率为转化率为:
×100%=60%;达到平衡时混合气体的总物质的量为:0.08mol+0.024mol=0.32mol,混合气体的平均摩尔质量为:
=57.5g/mol,
故答案为:60%; 57.5 g/mol;
(5)升高温度,气体颜色会变深,说明升高温度平衡向左移动,二氧化氮浓度增大,四氧化二氮浓度减小,化学平衡常数减小,
故答案为:减小.
(6)由于He气是惰性气体,不参与反应,扩大体积后,c(NO2)和c(N2O4)都降低为原来的一半,使QC=
c增大,即此时QC>K,平衡会向左移动,
故答案为:向左移动; He气是惰性气体,不参与反应,扩大体积后,c(NO2)和c(N2O4)都降低为原来的一半,使QC=
c增大,即此时QC>K,平衡会向左移动.
| ||
|
故答案为:0.15;
(2)反应达到60s时达到化学平衡状态,二氧化氮的物质的量不再变化,所以n3=n4,
2NO2 ?N2O4
初始:0.4mol 0
转化:0.16mol 0.08mol
平衡:0.24mol 0.08mol
则平衡时的浓度分别为:c(N2O4)=
| 0.08mol |
| 2L |
| 0.24mol |
| 2L |
k=
| c(N2O4) |
| c(NO2) |
| 0.04 |
| 0.122 |
故答案为:=;2.8;
(3)根据反应 2NO2 ?N2O4可知,0.4molNO2与0.2molN2O4相当,若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是:
| 0.2mol |
| 2L |
 ,
,故答案为:0.1mol/L;
 ;
;(4)根据等效平衡,在(3)中条件下达到平衡后四氧化二氮的物质的量为0.08mol,与充入二氧化氮为相同平衡状态,则反应消耗的四氧化二氮的物质的量为0.2mol-0.08mol=0.12mol,同时生成的二氧化氮的物质的量为:0.24mol,所以达到平衡后四氧化二氮的转化率为转化率为:
| 0.12mol |
| 0.2mol |
| 92g/mol×0.2mol |
| 0.32mol |
故答案为:60%; 57.5 g/mol;
(5)升高温度,气体颜色会变深,说明升高温度平衡向左移动,二氧化氮浓度增大,四氧化二氮浓度减小,化学平衡常数减小,
故答案为:减小.
(6)由于He气是惰性气体,不参与反应,扩大体积后,c(NO2)和c(N2O4)都降低为原来的一半,使QC=
| c(N2O4) |
| c(NO2)2 |
故答案为:向左移动; He气是惰性气体,不参与反应,扩大体积后,c(NO2)和c(N2O4)都降低为原来的一半,使QC=
| c(N2O4) |
| c(NO2)2 |
点评:本题考查化学平衡移动以及相关计算,题目较为综合,涉及多方面的知识,难度较大,本题中注意把握等效平衡的解题应用以及平衡常数的理解和应用问题,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
下列各组离子,在水溶液中能大量共存的是( )
| A、H+,Cl-,Na+,ClO- |
| B、CO32-,HCO3-,K+,H+ |
| C、Ca2+,K+,H+,SiO32- |
| D、Na+,S2-,SO32-,OH- |
有一Na2S,Na2SO3和Na2SO4混合物,经测是含硫25.6%(质量分数),则比混合物含氧量为( )
| A、37.6% | B、36.8% |
| C、51.2% | D、无法计算 |
用质量均为100g的Cu作电极电解AgNO3溶液,电解一段时间后,两电极质量相差28g,此时两电极质量分别是( )
| A、阳极93.6g,阴极121.6g |
| B、阳极100 g,阴极128.0g |
| C、阳极91.0g,阴极119.0g |
| D、阳极86.0g,阴极114.0g |

