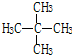题目内容
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
(1)可以判断该分解反应已经达到化学平衡的是 .
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)根据表中数据,列出该反应的平衡常数表达式:,并计算25.0℃时的分解平衡常数: .
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量 (填“增加”、“减小”或“不变”).
(4)氨基甲酸铵分解反应的焓变△H 0,熵变△S 0(填“>、<或=”).
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)根据表中数据,列出该反应的平衡常数表达式:,并计算25.0℃时的分解平衡常数:
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量
(4)氨基甲酸铵分解反应的焓变△H
考点:化学平衡状态的判断,化学平衡常数的含义,化学平衡的影响因素
专题:化学平衡专题,化学反应速率专题
分析:(1)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,由此进行判断;
(2)化学平衡常数K=
,固体和纯溶剂不列入表达式中,并根据平衡数据来计算;
(3)根据压强对化学平衡移动的影响来回答判断;
(4)根据温度对化学平衡移动的影响以及反应前后气体量的变化来确定焓变和熵变的符号.
(2)化学平衡常数K=
| 各个生成物平衡浓度系数次方的乘积 |
| 各个反应物平衡浓度系数次方的乘积 |
(3)根据压强对化学平衡移动的影响来回答判断;
(4)根据温度对化学平衡移动的影响以及反应前后气体量的变化来确定焓变和熵变的符号.
解答:
解:(1)A.2v(NH3)═v(CO2),不能说明正逆反应速率相等,不一定是平衡状态,故A错误;
B.反应是一个前后系数和变化的反应,密闭容器中总压强不变,证明达到了平衡状态,故B正确;
C.密闭容器中混合气体的密度ρ=
,质量不守恒,分子变化,V不变,容器中总密度不变,证明达到了平衡状态,故C正确;
D.密闭容器中氨气的体积分数不变,不能证明达到平恒状态,故D错误.
故选BC;
(2)反应NH2COONH4(s)?2NH3(g)+CO2(g)的K=c2(NH3)?c(CO2),设二氧化碳浓度的变化量x,
NH2COONH4(s)?2NH3(g)+CO2(g)
初始浓度:0 0
变化浓度:2x x
平衡浓度:2x x
则3x=4.8×10-3mol/L,即x=1.6×10-3mol/L,K=1.6×10-3mol/L×(3.2×10-3)2≈1.6×10-8(mol?L-1)3,故答案为:c2(NH3)?c(CO2),;1.6×10-8(mol?L-1)3;
(3)若在恒温下压缩容器体积,则会将压强增大,平衡向左移动,固体质量增大,故答案为:增加;
(4)根据表中的数据分析:温度越高,则平衡气体的总浓度越大,所以升高温度,平衡正向移动,反应是吸热的,反应物是固体,产物是气体,该反应是熵增加的过程,即△H>0,△S>0,故答案为:>;>.
B.反应是一个前后系数和变化的反应,密闭容器中总压强不变,证明达到了平衡状态,故B正确;
C.密闭容器中混合气体的密度ρ=
| m |
| V |
D.密闭容器中氨气的体积分数不变,不能证明达到平恒状态,故D错误.
故选BC;
(2)反应NH2COONH4(s)?2NH3(g)+CO2(g)的K=c2(NH3)?c(CO2),设二氧化碳浓度的变化量x,
NH2COONH4(s)?2NH3(g)+CO2(g)
初始浓度:0 0
变化浓度:2x x
平衡浓度:2x x
则3x=4.8×10-3mol/L,即x=1.6×10-3mol/L,K=1.6×10-3mol/L×(3.2×10-3)2≈1.6×10-8(mol?L-1)3,故答案为:c2(NH3)?c(CO2),;1.6×10-8(mol?L-1)3;
(3)若在恒温下压缩容器体积,则会将压强增大,平衡向左移动,固体质量增大,故答案为:增加;
(4)根据表中的数据分析:温度越高,则平衡气体的总浓度越大,所以升高温度,平衡正向移动,反应是吸热的,反应物是固体,产物是气体,该反应是熵增加的过程,即△H>0,△S>0,故答案为:>;>.
点评:本题涉及化学平衡的判断、化学平衡常数的计算、化学平衡的移动等知识,属于综合知识的考查,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于18O的说法中正确的是( )
| A、该原子核内有18个质子 |
| B、该原子核内有8个中子 |
| C、该原子核外有8个电子 |
| D、该原子的质量数为26 |
若以NA表示阿伏加德罗常数,下列说法正确的是( )
| A、加热时1 mol Fe与1 mol Cl2能恰好完全反应生成1 mol FeCl2,转移电子数为2NA |
| B、标准状况下,22.4L己烷中含碳原子数为6NA |
| C、30g甲醛中含共用电子对总数为3NA |
| D、3.9g Na2O2与3.1g Na2O组成的混合物中所含离子总数为0.3NA |
设NA表示阿伏加德罗常数,下列说法正确的是( )
| A、286g Na2CO3?10H2O固体中含有NA个阴离子 |
| B、9.2g金属钠投入到足量的重水中,则产生的气体中含有0.2mol电子 |
| C、25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
| D、0.1 L 浓度为3 mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 |
 和
和 D.35Cl和37Cl E.乙醇和乙二醇
D.35Cl和37Cl E.乙醇和乙二醇 A,B,C,D,E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57;B原子的L层P轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同,E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
A,B,C,D,E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57;B原子的L层P轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同,E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态. 在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
 和
和