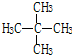题目内容
某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Fe3+、Al3+、Cu2+、Mg2+):

常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见表:
(1)酸浸时,为了提高浸取效率可采取的措施是 (至少写一条).
(2)加入H2O2目的是氧化 离子,其有关的离子方程式 (写一种).针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、H、O,化学式量为89,其化学式是 .
(3)调pH=8是为了将 离子(从Fe3+、Al3+、Cu2+、Mg2+中选择)以氢氧化物沉淀的形式除去.滤出的沉淀中部分沉淀将溶解于足量的氢氧化钠溶液中,其有关的离子方程式是 ,取少量上层澄清溶液,向其中通入足量的CO2,又能重新得到相应的沉淀,其有关的离子方程式为 .
(4)试配平最后一步相关的氧化还原方程式:
Na2Cr2O7+ SO2+ H2O= Cr(OH)(H2O)5SO4+ Na2SO4,每生成1mol Cr(OH)(H2O)5SO4时,该反应中转移的电子数为 .

常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 9.3 | 3.7 | 4.7 | --- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 6.7 | 9(>9 溶解) |
(2)加入H2O2目的是氧化
(3)调pH=8是为了将
(4)试配平最后一步相关的氧化还原方程式:
考点:物质的分离、提纯的基本方法选择与应用,氧化还原反应的电子转移数目计算,氧化还原反应方程式的配平
专题:氧化还原反应专题,化学实验基本操作
分析:(1)酸浸时,为了提高浸取率可采取的措施是延长浸取时间、加快溶解速度等措施;硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,酸浸是溶解物质为了提高浸取率,可以升高温度增大物质溶解度,增大接触面积增大反应速率,或加快搅拌速度等;
(2)根据双氧水的性质分析,双氧水有强氧化性,能氧化还原性的物质;
(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,Fe3+、Al3+转化为沉淀除去;
(4)依据流程图中的转化关系和产物,结合二氧化硫的还原性,利用氧化还原反应原理分析书写,根据方程式计算.
(2)根据双氧水的性质分析,双氧水有强氧化性,能氧化还原性的物质;
(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,Fe3+、Al3+转化为沉淀除去;
(4)依据流程图中的转化关系和产物,结合二氧化硫的还原性,利用氧化还原反应原理分析书写,根据方程式计算.
解答:
解:(1)酸浸时,为了提高浸取率可采取的措施是:增加浸取时间、不断搅拌混合物、滤渣多次浸取等,
故答案为:升高温度、搅拌、延长浸取时间、过滤后再次浸取;
(2)双氧水有强氧化性,能氧化还原性的物质,Fe2+和Cr3+有还原性,Fe2+和Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离,
其中Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,针铁矿组成元素是Fe、H、O,化学式量为89,则1mol该物质中应含有1molFe,则H、O的质量为89-56=33,可知应含有2molO和1molH,化学式应为FeO(OH),
故答案为:Fe2+;2Fe2++H2O2+2H+=2Fe3++2H2O;FeO(OH);
(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,由于Fe3+以针铁矿形成已经沉淀,则加入NaOH溶液使溶液呈碱性,溶液PH=8,Al3+、Cu2+转化为沉淀除去,滤出的沉淀中部分沉淀将溶解于足量的氢氧化钠溶液中,涉及反应为Al(OH)3+OH-=AlO2-+2H2O,
取少量上层澄清溶液,向其中通入足量的CO2,又能重新得到相应的沉淀,涉及反应为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-,
故答案为:Al3+、Cu2+;Al(OH)3+OH-=AlO2-+2H2O;AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-;
(4)二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2Cr2O7氧化为硫酸,Na2Cr2O7氧被还原为CrOH(H2O)5SO4,水溶液中生成硫酸反应生成硫酸钠,依据原子守恒分析书写配平方程式为Na2Cr2O7+3SO2+11H2O═2CrOH(H2O)5SO4↓+Na2SO4,
由方程式可知,Cr元素化合价降低3价,则每生成1mol Cr(OH)(H2O)5SO4时,转移3NA电子,
故答案为:1;3;11;2;1;3NA.
故答案为:升高温度、搅拌、延长浸取时间、过滤后再次浸取;
(2)双氧水有强氧化性,能氧化还原性的物质,Fe2+和Cr3+有还原性,Fe2+和Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离,
其中Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,针铁矿组成元素是Fe、H、O,化学式量为89,则1mol该物质中应含有1molFe,则H、O的质量为89-56=33,可知应含有2molO和1molH,化学式应为FeO(OH),
故答案为:Fe2+;2Fe2++H2O2+2H+=2Fe3++2H2O;FeO(OH);
(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,由于Fe3+以针铁矿形成已经沉淀,则加入NaOH溶液使溶液呈碱性,溶液PH=8,Al3+、Cu2+转化为沉淀除去,滤出的沉淀中部分沉淀将溶解于足量的氢氧化钠溶液中,涉及反应为Al(OH)3+OH-=AlO2-+2H2O,
取少量上层澄清溶液,向其中通入足量的CO2,又能重新得到相应的沉淀,涉及反应为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-,
故答案为:Al3+、Cu2+;Al(OH)3+OH-=AlO2-+2H2O;AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-;
(4)二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2Cr2O7氧化为硫酸,Na2Cr2O7氧被还原为CrOH(H2O)5SO4,水溶液中生成硫酸反应生成硫酸钠,依据原子守恒分析书写配平方程式为Na2Cr2O7+3SO2+11H2O═2CrOH(H2O)5SO4↓+Na2SO4,
由方程式可知,Cr元素化合价降低3价,则每生成1mol Cr(OH)(H2O)5SO4时,转移3NA电子,
故答案为:1;3;11;2;1;3NA.
点评:本题考查了离子方程式的书写、物质的分离等知识点,难度不大,注意会运用溶液的pH值对溶液中的离子进行分离,除杂的原则是:除去杂质且不引进新的杂质.

练习册系列答案
相关题目
将5.6LCO2气体缓慢通过一定量的Na2O2固体后,得到3.36L气体(气体体积均在标准状况下测定),所得气体的质量为( )
| A、3.8g | B、4.8g |
| C、5.4g | D、6.6g |
表示下列反应的离子方程式正确的是( )
| A、铁溶于稀盐酸:2Fe+6H+=2Fe3++3H2↑ | ||||
| B、氯化铝溶液中加过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ | ||||
C、碳酸氢铵溶液中加足量氢氧化钠并加热:NH4++OH-
| ||||
| D、氯气通入水中,溶液呈酸性:Cl2+H2O?2H++Cl-+ClO- |
标准状况下,在臭氧发生器中装入100mL氧气,最后的体积变为95mL.则最终状态时混合气体的密度是( )
| A、1.3g?L-1 |
| B、1.5g?L-1 |
| C、1.7g?L-1 |
| D、1.9g?L-1 |
 和
和 D.35Cl和37Cl E.乙醇和乙二醇
D.35Cl和37Cl E.乙醇和乙二醇 A,B,C,D,E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57;B原子的L层P轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同,E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
A,B,C,D,E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57;B原子的L层P轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同,E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态. 在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据: 和
和