题目内容
将标准状况下一定体积的CO2缓缓通入体积为V升的NaOH溶液中,充分反应后,在减压低温的条件下蒸发溶液,得到白色固体
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,推断并写出各种可能组成的化学式(可以不填满,也可以增加序号)
① ,② ,③ ,④ .
(2)按反应的先后顺序写出各步反应的离子方程式: .
(3)若反应的CO2和NaOH均无剩余,反应后向溶液中加入过量的澄清石灰水生成a克白色沉淀
①根据以上数据,能否推理计算出标况下通入的CO2的体积?若能,用代数式表示的体积V(CO2)= 若不能,理由是 .
②根据以上数据,能否推理计算出NaOH溶液的浓度?若能,用代数式表示的浓度C(NaOH) 若不能,理由是 .
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,推断并写出各种可能组成的化学式(可以不填满,也可以增加序号)
①
(2)按反应的先后顺序写出各步反应的离子方程式:
(3)若反应的CO2和NaOH均无剩余,反应后向溶液中加入过量的澄清石灰水生成a克白色沉淀
①根据以上数据,能否推理计算出标况下通入的CO2的体积?若能,用代数式表示的体积V(CO2)=
②根据以上数据,能否推理计算出NaOH溶液的浓度?若能,用代数式表示的浓度C(NaOH)
考点:化学方程式的有关计算
专题:常规题型,计算题
分析:(1)分情况讨论,当氢氧化钠过量时碳酸碳酸钠且氢氧化钠剩余、当二氧化碳和氢氧化钠恰好反应生成碳酸钠、当二氧化碳和氢氧化钠反应生成碳酸钠和碳酸氢钠、当二氧化碳过量时生成碳酸氢钠;
(2)二氧化碳和氢氧化钠反应生成碳酸钠和水,二氧化碳和碳酸钠、水反应生成碳酸氢钠;
(3)①根据碳原子守恒计算二氧化碳体积;
②根据反应后溶液中的溶质判断.
(2)二氧化碳和氢氧化钠反应生成碳酸钠和水,二氧化碳和碳酸钠、水反应生成碳酸氢钠;
(3)①根据碳原子守恒计算二氧化碳体积;
②根据反应后溶液中的溶质判断.
解答:
解:(1)①n(NaOH):n(CO2)>2:1,所以得到的固体为NaOH和Na2CO3;
②n(NaOH):n(CO2)=2时,得到的固体为Na2CO3;
③当1<n(NaOH):n(CO2)<2时,得到的固体为Na2CO3和NaHCO3;
④当n(NaOH):n(CO2)<1:1时,得到的固体是NaHCO3,
故答案为:NaOH和Na2CO3;Na2CO3;Na2CO3和NaHCO3;NaHCO3;
(2)二氧化碳和氢氧化钠反应生成碳酸钠和水,二氧化碳和碳酸钠、水反应生成碳酸氢钠,离子反应方程式分别为:2OH-+CO2=CO32-+H2O、CO32-+H2O+CO2=2HCO3-,故答案为:2OH-+CO2=CO32-+H2O、CO32-+H2O+CO2=2HCO3-;
(3)①根据碳原子守恒得n(CO2)=n(CaCO3)=
,V(CO2)=
mol×22.4L/mol=0.224aL,
故答案为:0.224aL;
②当后应后的生成物只有NaHCO3时,根据钠原子守恒得n(NaOH)=n(NaHCO3),根据碳原子守恒得n(CaCO3)=n(NaHCO3)=
mol,C(NaOH)=
=
mol/L;
当反应后的生成物只有Na2CO3时,根据钠原子守恒得n(NaOH)=2n(Na2CO3),根据碳原子守恒得n(CaCO3)=n(NaHCO3)=
mol,C(NaOH)=
=
mol/L;
当反应后的生成物是Na2CO3和NaHCO3时,消耗的NaOH在上述的二者之间,所以NaOH溶液的物质的量浓度不能确定,
故答案为:当后应后的生成物只有NaHCO3时,根据钠原子守恒得n(NaOH)=n(NaHCO3),根据碳原子守恒得n(CaCO3)=n(NaHCO3)=
mol,C(NaOH)=
=
mol/L;
当反应后的生成物只有Na2CO3时,根据钠原子守恒得n(NaOH)=2n(Na2CO3),根据碳原子守恒得n(CaCO3)=n(NaHCO3)=
mol,C(NaOH)=
=
mol/L;
当反应后的生成物是Na2CO3和NaHCO3时,消耗的NaOH在上述的二者之间,所以NaOH溶液的物质的量浓度不能确定.
②n(NaOH):n(CO2)=2时,得到的固体为Na2CO3;
③当1<n(NaOH):n(CO2)<2时,得到的固体为Na2CO3和NaHCO3;
④当n(NaOH):n(CO2)<1:1时,得到的固体是NaHCO3,
故答案为:NaOH和Na2CO3;Na2CO3;Na2CO3和NaHCO3;NaHCO3;
(2)二氧化碳和氢氧化钠反应生成碳酸钠和水,二氧化碳和碳酸钠、水反应生成碳酸氢钠,离子反应方程式分别为:2OH-+CO2=CO32-+H2O、CO32-+H2O+CO2=2HCO3-,故答案为:2OH-+CO2=CO32-+H2O、CO32-+H2O+CO2=2HCO3-;
(3)①根据碳原子守恒得n(CO2)=n(CaCO3)=
| ag |
| 100g/mol |
| a |
| 100 |
故答案为:0.224aL;
②当后应后的生成物只有NaHCO3时,根据钠原子守恒得n(NaOH)=n(NaHCO3),根据碳原子守恒得n(CaCO3)=n(NaHCO3)=
| a |
| 100 |
| ||
| VL |
| a |
| 100V |
当反应后的生成物只有Na2CO3时,根据钠原子守恒得n(NaOH)=2n(Na2CO3),根据碳原子守恒得n(CaCO3)=n(NaHCO3)=
| a |
| 100 |
| ||
| VL |
| a |
| 50V |
当反应后的生成物是Na2CO3和NaHCO3时,消耗的NaOH在上述的二者之间,所以NaOH溶液的物质的量浓度不能确定,
故答案为:当后应后的生成物只有NaHCO3时,根据钠原子守恒得n(NaOH)=n(NaHCO3),根据碳原子守恒得n(CaCO3)=n(NaHCO3)=
| a |
| 100 |
| ||
| VL |
| a |
| 100V |
当反应后的生成物只有Na2CO3时,根据钠原子守恒得n(NaOH)=2n(Na2CO3),根据碳原子守恒得n(CaCO3)=n(NaHCO3)=
| a |
| 100 |
| ||
| VL |
| a |
| 50V |
当反应后的生成物是Na2CO3和NaHCO3时,消耗的NaOH在上述的二者之间,所以NaOH溶液的物质的量浓度不能确定.
点评:本题考查了物质的量的有关计算,以二氧化碳和氢氧化钠反应生成碳酸钠、碳酸氢钠为分界点进行分析,再结合原子守恒解答,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知:Ka(HA)>Ka(HB).现有温度、物质的量浓度和体积均相同的NaA和NaB两种溶液,若前者溶液中所有离子数目为n1,后者的所有离子数目为n2,下列关系式正确的是( )
| A、n1=n2 |
| B、n1>n2 |
| C、n1<n2 |
| D、C(A-)<C(B-) |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、常温常压下,NO2和N2O4的混合物46g中含有2NA个氧原子 |
| B、常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA |
| C、10mL98%的浓H2SO4用水稀释至l00mL,H2SO4的质量分数为9.8% |
| D、标准状况下,80g SO3中含3NA个氧原子,体积约为22.4L |
下列化学反应对应的离子方程式书写正确的是( )
| A、用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
| B、醋酸溶液和大理石反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、NH4Al(SO4)2溶液中滴加少量的NaOH:NH4++OH-=NH3?H2O |
| D、向Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2↑+S↓+H2O |
 在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据: 已知原子序数依次增大的A、B、C、D、E五种元素中有2种为非金属元素,其原子序数均小于30.其中A、B、C、E的价电子层中均有2个未成对电子,A、B同族且可以形成原子个数比为1:1的化合物BA,属于原子晶体.回答下列问题:
已知原子序数依次增大的A、B、C、D、E五种元素中有2种为非金属元素,其原子序数均小于30.其中A、B、C、E的价电子层中均有2个未成对电子,A、B同族且可以形成原子个数比为1:1的化合物BA,属于原子晶体.回答下列问题: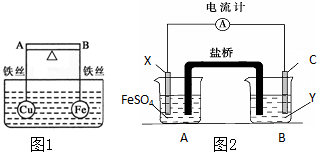 (1)如图1所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)当杠杆为绝缘体时,A端比B端
(1)如图1所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)当杠杆为绝缘体时,A端比B端