题目内容
(1)铜粉放入稀H2SO4中,加热后无明显现象,当加入KNO3 后,铜粉质量减小,溶液变蓝,同时有气体逸出,该反应的离子方程式为 .
(2)在含Cu+的酶的活化中心内,亚硝酸根离子(NO
)可转化为NO,写出Cu+与亚硝酸根离子在酸性水溶液中反应的离子方程式 .
(2)在含Cu+的酶的活化中心内,亚硝酸根离子(NO
- 2 |
考点:离子方程式的书写,硝酸的化学性质,亚硝酸盐
专题:离子反应专题
分析:(1)硝酸盐在酸性条件下,具有强氧化性,与Cu反应生成NO和水;
(2)Cu+与亚硝酸根离子在酸性水溶液中发生氧化还原反应,生成铜离子、NO和水.
(2)Cu+与亚硝酸根离子在酸性水溶液中发生氧化还原反应,生成铜离子、NO和水.
解答:
解:(1)硝酸盐在酸性条件下,具有强氧化性,与Cu反应生成NO和水,该离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(2)Cu+与亚硝酸根离子在酸性水溶液中发生氧化还原反应,生成铜离子、NO和水,该离子反应为Cu++2H++NO2-═Cu2++NO↑+H2O,
故答案为:Cu++2H++NO2-═Cu2++NO↑+H2O.
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(2)Cu+与亚硝酸根离子在酸性水溶液中发生氧化还原反应,生成铜离子、NO和水,该离子反应为Cu++2H++NO2-═Cu2++NO↑+H2O,
故答案为:Cu++2H++NO2-═Cu2++NO↑+H2O.
点评:本题考查离子反应的书写,为高频考点,把握发生的氧化还原反应,明确反应物、生成物及离子反应的书写方法即可解答,题目难度不大.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
表示下列反应的离子方程式正确的是( )
| A、铁溶于稀盐酸:2Fe+6H+=2Fe3++3H2↑ | ||||
| B、氯化铝溶液中加过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ | ||||
C、碳酸氢铵溶液中加足量氢氧化钠并加热:NH4++OH-
| ||||
| D、氯气通入水中,溶液呈酸性:Cl2+H2O?2H++Cl-+ClO- |
若以NA表示阿伏加德罗常数,下列说法正确的是( )
| A、加热时1 mol Fe与1 mol Cl2能恰好完全反应生成1 mol FeCl2,转移电子数为2NA |
| B、标准状况下,22.4L己烷中含碳原子数为6NA |
| C、30g甲醛中含共用电子对总数为3NA |
| D、3.9g Na2O2与3.1g Na2O组成的混合物中所含离子总数为0.3NA |
已知,常温下某浓度NaHSO3稀溶液的pH<7.则该稀溶液中下列粒子关系正确的是( )
| A、c(Na+)>c(HSO3-)>c(H+)>c(OH-) |
| B、c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| C、c(OH-)+c(SO32-)=c(H2SO3)+c(H+) |
| D、c(Na+)+c(H+)=c(HSO3-)+c(OH-) |
标准状况下,在臭氧发生器中装入100mL氧气,最后的体积变为95mL.则最终状态时混合气体的密度是( )
| A、1.3g?L-1 |
| B、1.5g?L-1 |
| C、1.7g?L-1 |
| D、1.9g?L-1 |
 在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据: 和
和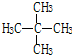
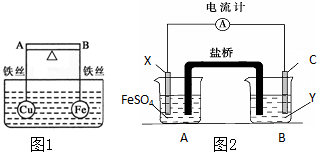 (1)如图1所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)当杠杆为绝缘体时,A端比B端
(1)如图1所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)当杠杆为绝缘体时,A端比B端