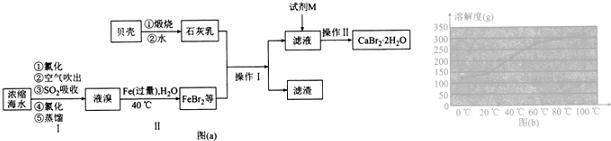
题目内容
4.某温度下,在一个2L的密闭容器中加入4mol A和2mol B进行如下反应:3A(g)+2B(g)?4C(?)+2D(g).“?“代表状态不确定.反应一段时间后达到平衡,测得生成1.6mol C,则下列说法正确的是( )| A. | 其他条件不变,增大该体系的压强,平衡正向移动,则C为气体 | |
| B. | 其他条件不变.若升高温度.B的平衡转化率增大.则该反应是放热反应 | |
| C. | 该反应的化学平衡常数表达式为K=$\frac{{c}^{4}(C)•{c}^{2}(D)}{{c}^{3}(A)•{c}^{2}(B)}$ | |
| D. | 此时.B的平衡转化率是40% |
分析 A.压强增大平衡向气体体积减小的方向进行;
B.升温平衡想吸热反应方向进行;
C.平衡常数表达式是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积表示,固体和纯液体不写入;
D.结合化学平衡三行计算得到转化率,转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:A.其他条件不变,增大该体系的压强,平衡正向移动,说明正反应为气体体积减小的反应,则C不为气体,故A错误;
B.升温平衡向吸热反应方向进行,其他条件不变.若升高温度.B的平衡转化率增大.说明上午平衡正向进行,正反应为吸热反应,故B错误;
C.平衡常数表达式是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积表示,固体和纯液体不写入,C的状态不确定,表达式不一定,故C错误;
D.结合化学平衡三行计算得到转化率,
3A(g)+2B(g)?4C(?)+2D(g)
起始量(mol) 4 2 0 0
变化量(mol) 1.2 0.8 1.6 0.8
平衡量(mol) 2.8 1.2 1.6 0.8
转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.8mol}{2mol}$×100%=40%,故D正确;
故选D.
点评 本题考查了好像平衡的过程建立、化学平衡常数表示方法、化学平衡的计算分析,掌握基础是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14. 甲苯(
甲苯(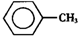 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(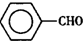 )、苯甲酸(
)、苯甲酸(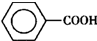 )等产品.下表列出了有关物质的部分物理性质,请回答:
)等产品.下表列出了有关物质的部分物理性质,请回答:
注:甲苯、苯甲醛、苯甲酸三者互溶; 酸性:苯甲酸>醋酸
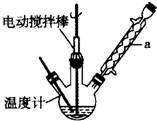
实验室可用如图装置模拟制备苯甲醛.实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时.
(1)装置a的名称是球形冷凝管,主要作用是冷凝回流,防止甲苯的挥发而降低产品产率.三颈瓶中发生反应的化学方程式为 ,此反应的原子利用率理论上可达66.25%.
,此反应的原子利用率理论上可达66.25%.
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是H2O2在较高温度时分解速度加快,使实际参加反应的H2O2减少,影响产量.
(3)反应完毕后,反应混合液经过自然冷却至室温时,还应经过过滤、蒸馏(填操作名称)等操作,才能得到苯甲醛粗产品.
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸.
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是dacb(按步骤顺序填字母).
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加人盐酸调节pH=2 d.与适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取1.200g产品,溶于100mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000moL/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL.产品中苯甲酸的质量分数为91.50%.
③下列情况会使测定结果偏低的是ad(填字母).
a.滴定终点时俯视读取耗碱量 b.KOH标准液长时间接触空气
c.配置KOH标准液时仰视定容 d.将酚酞指示剂换为甲基橙溶液.
 甲苯(
甲苯( )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛( )、苯甲酸(
)、苯甲酸( )等产品.下表列出了有关物质的部分物理性质,请回答:
)等产品.下表列出了有关物质的部分物理性质,请回答:| 称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
实验室可用如图装置模拟制备苯甲醛.实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时.
(1)装置a的名称是球形冷凝管,主要作用是冷凝回流,防止甲苯的挥发而降低产品产率.三颈瓶中发生反应的化学方程式为
 ,此反应的原子利用率理论上可达66.25%.
,此反应的原子利用率理论上可达66.25%.(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是H2O2在较高温度时分解速度加快,使实际参加反应的H2O2减少,影响产量.
(3)反应完毕后,反应混合液经过自然冷却至室温时,还应经过过滤、蒸馏(填操作名称)等操作,才能得到苯甲醛粗产品.
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸.
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是dacb(按步骤顺序填字母).
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加人盐酸调节pH=2 d.与适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取1.200g产品,溶于100mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000moL/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL.产品中苯甲酸的质量分数为91.50%.
③下列情况会使测定结果偏低的是ad(填字母).
a.滴定终点时俯视读取耗碱量 b.KOH标准液长时间接触空气
c.配置KOH标准液时仰视定容 d.将酚酞指示剂换为甲基橙溶液.
12.下列说法不正确的是( )
| A. | 钠、钾着火时,不能用泡沫灭火器灭火 | |
| B. | 氧化铝是冶炼金属铝的原料,也是较好的耐火材料 | |
| C. | 石英是制造光导纤维的原料,也是常用的半导体材料 | |
| D. | 在汽车尾气系统中装催化转化器,可降低尾气中CO、NOx等的排放量 |
19.下列说法正确的是( )
| A. | 1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热 | |
| B. | 101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 | |
| C. | CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 | |
| D. | 25℃、101 kPa时,1 mol S和2 mol S的燃烧热相等 |
9.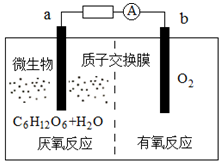 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )
 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )| A. | b极为正极,发生氧化反应 | |
| B. | 外电路中电子的移动方向为:b→a | |
| C. | 质子通过交换膜从b极区移向a极区 | |
| D. | 电池总反应为C6H12O6+6O2=6CO2+6H2O |
16.实验室里需用480mL 0.1mol•L-1的硫酸铜溶液,以下说法正确的是( )
| A. | 称取8.0g硫酸铜,加入500mL水 | |
| B. | 称取12.0g胆矾配成500mL溶液 | |
| C. | 定容摇匀后液面下降,应加水至凹液面最低点与刻线相平 | |
| D. | 定容时仰视刻线会使所配溶液浓度偏小 |