题目内容
20.常温下,有0.1mol/L的盐酸和01mol/L的醋酸溶液,回答下列问题:①比较两溶液的pH,盐酸<(填“<”、“=”或“>”)醋酸,写出醋酸电离的方程式CH3COOH?CH3COO-+H+.
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈碱性(填“酸”、“中”或“碱”),其原因是(用离子方程式表示)CH3COO-+H2O?CH3COOH+OH-.
分析 ①强酸溶液中氢离子浓度等于酸浓度,弱酸溶液中氢离子浓度小于酸浓度,根据氢离子浓度确定溶液PH值的相对大小,醋酸是弱酸,在水中只有部分电离,注意醋酸的电离方程式要写可逆号;
②醋酸钠是强碱弱酸盐,因水解导致其溶液呈碱性.
解答 解:①氯化氢是强电解质,在水中完全电离,所以盐酸溶液中氢离子浓度等于盐酸浓度,醋酸是弱电解质,在水中只有部分电离,醋酸溶液中氢离子浓度小于醋酸浓度,所以相同浓度的盐酸和醋酸溶液,醋酸溶液中氢离子浓度小于盐酸溶液中氢离子浓度,导致盐酸溶液的PH值小于醋酸溶液的pH值;
醋酸的电离方程式为:CH3COOH?CH3COO-+H+,
故答案为:<;CH3COOH?CH3COO-+H+;
②醋酸钠是强碱弱酸盐,因水解导致其溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,水解方程式为:CH3COO-+H2O?CH3COOH+OH-;
故答案为:碱; CH3COO-+H2O?CH3COOH+OH-.
点评 本题考查了弱电解质的电离,属于综合知识的考查,注意知识的积累是解题的关键,题目难度不大.

练习册系列答案
相关题目
10.向100mL 0.25mol•L-1的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是( )
| A. | 2.3 g | B. | 3.45 g | C. | 1.15 g | D. | 0.575 g |
11.下列实验设计不能达到预期目的是( )
| 实验设计 | 预期目的 | |
| A | 在相同温度下,分别取等质量的大理石块、大理石粉末分别与等体积等浓度的稀硫酸反应 | 探究反应物接触面积对化学反应速率的影响 |
| B | 把盛有颜色相同的NO2和N2O4的混合气体的两支试管(密封)分别浸入冷水和热水中 | 探究温度对化学平衡的影响 |
| C | 将铁棒和石墨用导线连接后插入含有Fe2+、Cu2+的盐溶液中 | 探究Fe2+和Cu2+的氧化性相对强弱 |
| D | 相同温度下,向两支盛有等体积等浓度H2O2溶液的试管中分别滴入适量的CuSO4溶液和FeCl3溶液 | 探究不同催化剂对同一反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
8.下列说法正确的是( )
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 酒精、硫酸钡和水分别属于电解质、强电解质和弱电解质 | |
| C. | 胶体区别于其它分散系的本质特性是具有丁达尔现象 | |
| D. | 利用半透膜可除去淀粉溶液中的少量NaCl |
15.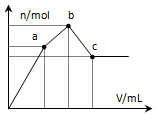 向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
 向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A. | a点的溶液呈中性 | |
| B. | 从开始到b点发生反应的总的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ | |
| C. | c点加入Ba(OH)2溶液的体积为200 mL | |
| D. | c点溶液呈碱性 |
5.一定量的盐酸跟过量的锌粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
| A. | Ca(NO3 )2(溶液) | B. | K2CO3(溶液) | C. | CH3COOK(固体) | D. | CuSO4 (固体) |
12.分子式为C10H14 的有机物有多种,其中苯环上的二元取代物共有( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
9.常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
| A. | 某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,该溶液pH一定为14-a | |
| B. | 等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | 将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>c(Na+)>c(A-) | |
| D. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+) |
10.甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如下(反应条件及其它产物已略去).下列说法正确的是( )
甲$→_{①}^{+丁}$乙$→_{②}^{+丁}$丙.
甲$→_{①}^{+丁}$乙$→_{②}^{+丁}$丙.
| A. | 丁一定是氧化剂 | B. | 甲只能是 S 或 N2 | ||
| C. | 乙一定是氧化物 | D. | 反应②可能是非氧化还原反应 |