题目内容
15.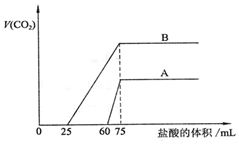 取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸体积之间的关系如图所示,试回答下列问题:
取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸体积之间的关系如图所示,试回答下列问题:(1)曲线A表明,原溶液中通入CO2后,所得溶液中溶质的化学式为NaOH、Na2CO3,加盐酸后产生CO2体积的最大值为33.6mL.
(2)曲线B表明,原溶液中通入CO2后,所得溶液中溶质的化学式为Na2CO3、NaHCO3,加盐酸后产生CO2体积最大值为112mL.
(3)通过计算,求出原NaOH溶液的物质的量浓度为0.75mol/L.
分析 (1)由图可知,对应A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积为60mL,远远大于碳酸氢钠生成氯化钠需要盐酸的体积(75-60)mL=15mL,说明原溶液中的溶质是NaOH和Na2CO3;
生成二氧化碳消耗盐酸的体积为75mL-60mL=15mL,生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,根据n=cV计算n(HCl),再根据方程式计算二氧化碳的体积;
(2)对于B溶液来说,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积25mL小于碳酸氢钠生成氯化钠需要盐酸的体积(75-25)mL=50mL,说明原溶液中的溶质是Na2CO3和NaHCO3;生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,根据n=cV计算n(HCl),再根据方程式计算二氧化碳的体积;
(3)先向氢氧化钠溶液中通入二氧化碳,后向通入二氧化碳的氢氧化钠溶液中滴加盐酸,当二氧化碳气体完全放出时,溶液的溶质是氯化钠,该反应的实质是盐酸和氢氧化钠反应生成氯化钠,根据盐酸的物质的量计算氢氧化钠的物质的量浓度.
解答 解:(1)由图可知,对应A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积为60mL,远远大于碳酸氢钠生成氯化钠需要盐酸的体积(75-60)mL=15mL,说明原溶液中的溶质是NaOH和Na2CO3;
生成二氧化碳消耗盐酸的体积为:75mL-60mL=15mL,生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,由方程式可知:n(CO2)=n(HCl)=0.015L×0.1mol/L=0.0015mol,标况下体积为0.0015mol×22.4L/mol=0.0336L=33.6mL,
故答案为:NaOH、Na2CO3;33.6;
(2)对于B溶液来说,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积25mL小于碳酸氢钠生成氯化钠需要盐酸的体积(75-25)mL=50mL,说明原溶液中的溶质是Na2CO3和NaHCO3,生成二氧化碳消耗盐酸的体积为75mL-25mL=50mL,生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,由方程式可知,n(CO2)=n(HCl)=0.05L×0.1mol/L=0.005mol,标况下体积为0.005mol×22.4L/mol=0.112L=112mL,
故答案为:Na2CO3和NaHCO3;112;
(3)先向氢氧化钠溶液中通入二氧化碳,后向通入二氧化碳的氢氧化钠溶液中滴加盐酸,当二氧化碳气体完全放出时,溶液的溶质是氯化钠,该反应的实质是盐酸和氢氧化钠反应生成氯化钠,盐酸和氢氧化钠反应的物质的量之比为1:1,
设氢氧化钠的物质的量浓度为cmol/L,加入75mL盐酸时二氧化碳的体积达最大,此时溶液为氯化钠溶液;根据氯离子、钠离子守恒,所以n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=7.5×10-3mol,c(NaOH)=$\frac{n}{V}$=$\frac{7.5×1{0}^{-3}mol}{0.01L}$=0.75mol/L,根据溶液具有均一性可知,原NaOH溶液的浓度为0.75mol/L,
故答案为:0.75mol/L.
点评 本题考查混合物的有关计算,侧重分析与计算能力、图象与反应对应关系判断能力的考查,根据消耗盐酸体积判断溶质成分为解答关键,题目难度较大.

①皂化反应
②给装有氯化铵的试管加热,在管口又有白色晶体产生
③太阳光照在装有氯水的瓶子上,瓶子里有气泡产生
④碘受热有紫色蒸气产生
⑤碳酸钠晶体的风化
⑥向皂化后的溶液中加入氯化钠粉末使肥皂析出
⑦铁、铝常温遇浓硫酸发生钝化
⑧二氧化氮气体遇冷颜色变浅.
| A. | ①⑤⑥ | B. | ④⑥ | C. | ②④⑦ | D. | ③④⑧ |
| A. | 2.3 g | B. | 3.45 g | C. | 1.15 g | D. | 0.575 g |
| A. | 分散系的分类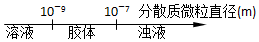 | |
| B. | Fe与Cl2反应的产物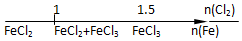 | |
| C. | 向AlCl3溶液滴加NaOH溶液后铝的存在形式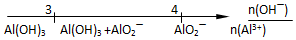 | |
| D. | Na与O2反应的产物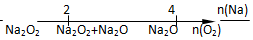 |
(1)计算:需要NaOH固体的质量为10.0g.
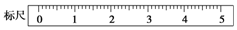
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将(填“高于”或“低于”)右边的托盘.欲使天平平衡,所进行的操作为将左边的平衡螺母左旋移动,或将右边的平衡螺母左旋,直至天平平衡.假定最终称得小烧杯的质量为32.6(填“32.6g”或“31.61g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在标尺上画出游码的位置(画“△”表示).
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码过程) |
(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温.
②继续往容量瓶中加蒸馏水至液面接近刻度线1~2cm.
③将NaOH溶液沿玻璃棒注入500mL容量瓶中.
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶.
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀.
试将以上操作排出先后顺序①③④②⑤.
(4)某学生实际配制NaOH溶液的浓度为0.48mol/L,原因可能是ACD.
A.使用滤纸称量氢氧化钠固体 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水后定容时仰视刻度.
| A. | Ca(NO3 )2(溶液) | B. | K2CO3(溶液) | C. | CH3COOK(固体) | D. | CuSO4 (固体) |
 .
.
 .
.