题目内容
18.某无色溶液X,由Na+、Ag+、Ba2+、Al3+、Fe3+、AlO2-、CO32-、SO42-中的若干种离子组成,取该溶液进行如下实验: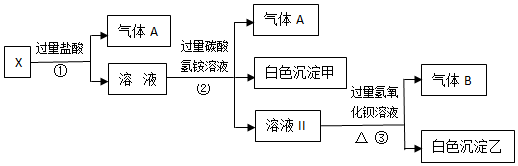
(1)气体A的成分是CO2(填化学式,下同),气体B的成分是NH3.
(2)写出步骤①发生反应的所有离子方程式CO32-+2H+═H2O+CO2↑、AlO2-+4H+═Al3++2H2O.
(3)写出步骤②形成白色沉淀甲的离子方程式Al3++3HCO3-═Al(OH)3↓+3CO2↑.
(4)通过上述实验,可确定X溶液中一定存在的离子是CO32-、AlO2-、Na+,尚未确定是否存在的离子是SO42-,只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是向所得沉淀乙中滴加足量的稀硝酸,若沉淀不完全溶解,则证明含有SO42-.
分析 溶液呈无色,则不含Fe3+,加入过量盐酸只产生气体,则一定含有CO32-,不含Ag+,反应后溶液呈酸性,加入过量碳酸氢铵溶液,生成气体和白色沉淀,则发生反应应为:Al3++3HCO3-═Al(OH)3↓+3CO2↑,则原溶液中含有AlO2-,则一定不含Ba2+、Al3+、Fe3+,因这些离子与AlO2-发生相互促进的水解而不能大量共存,根据溶液电中性原则,一定含有Na+,最后加入过量氢氧化钡溶液,因之前加入的碳酸氢铵过量,则生成的白色沉淀可能为BaCO3,不能确定SO42-是否存在,以此来解答.
解答 解:(1)气体A的成分是CO2,所涉及反应有:CO32-+2H+═H2O+CO2↑,Al3++3HCO3-═Al(OH)3↓+3CO2↑,气体B为NH3,所涉及反应为:NH4++OH-=NH3↑+H2O,故答案为:CO2;NH3;
(2)步骤①发生反应的所有离子方程式为CO32-+2H+═H2O+CO2↑、AlO2-+4H+═Al3++2H2O,故答案为:CO32-+2H+═H2O+CO2↑、AlO2-+4H+═Al3++2H2O;
(3)溶液中含有AlO2-,加入过量盐酸发生反应:AlO2-+4H+═Al3++2H2O,加入过量碳酸氢铵溶液,生成气体和白色沉淀,则步骤②形成白色沉淀甲的离子方程式为Al3++3HCO3-═Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-═Al(OH)3↓+3CO2↑;
(4)由以上分析可知,X溶液中一定存在的离子是CO32-,AlO2-,Na+,因最后加入过量氢氧化钡溶液,因之前加入的碳酸氢铵过量,则生成的白色沉淀可能为BaCO3,不能确定SO42-是否存在,可向所得沉淀乙中滴加足量的稀硝酸,若沉淀不完全溶解,则证明含有SO42-,
故答案为:CO32-、AlO2-、Na+;SO42-;向所得沉淀乙中滴加足量的稀硝酸,若沉淀不完全溶解,则证明含有SO42-.
点评 本题考查无机物的推断,为高频考点,把握离子的性质、发生的反应为解答的关键,侧重分析与推断能力的考查,注意沉淀的判断及元素化合物知识的应用,题目难度不大.

 名校课堂系列答案
名校课堂系列答案 短周期元素A、B、C,在周期表中所处的位置如图所示、A、B、C三种元素原子质子数之和为32.D元素原子的最外层电子数为其次外层电子数的2倍.则下列说法正确的是( )
短周期元素A、B、C,在周期表中所处的位置如图所示、A、B、C三种元素原子质子数之和为32.D元素原子的最外层电子数为其次外层电子数的2倍.则下列说法正确的是( )| A. | A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且反应类型相同 | |
| B. | A的气态氢化物比B的气态氢化物稳定,是由于A的氢化物分子间有氢键 | |
| C. | 元素D形成的气态氢化物一定是正四面体型分子 | |
| D. | 四种元素的原子半径:B>D>A>C |
①皂化反应
②给装有氯化铵的试管加热,在管口又有白色晶体产生
③太阳光照在装有氯水的瓶子上,瓶子里有气泡产生
④碘受热有紫色蒸气产生
⑤碳酸钠晶体的风化
⑥向皂化后的溶液中加入氯化钠粉末使肥皂析出
⑦铁、铝常温遇浓硫酸发生钝化
⑧二氧化氮气体遇冷颜色变浅.
| A. | ①⑤⑥ | B. | ④⑥ | C. | ②④⑦ | D. | ③④⑧ |
| A. | H2CO3═2H++CO32- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHCO3?Na++HCO3- | D. | Ba(OH)2═Ba2++2OH- |
| A. | 2.3 g | B. | 3.45 g | C. | 1.15 g | D. | 0.575 g |
(1)计算:需要NaOH固体的质量为10.0g.
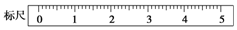
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将(填“高于”或“低于”)右边的托盘.欲使天平平衡,所进行的操作为将左边的平衡螺母左旋移动,或将右边的平衡螺母左旋,直至天平平衡.假定最终称得小烧杯的质量为32.6(填“32.6g”或“31.61g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在标尺上画出游码的位置(画“△”表示).
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码过程) |
(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温.
②继续往容量瓶中加蒸馏水至液面接近刻度线1~2cm.
③将NaOH溶液沿玻璃棒注入500mL容量瓶中.
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶.
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀.
试将以上操作排出先后顺序①③④②⑤.
(4)某学生实际配制NaOH溶液的浓度为0.48mol/L,原因可能是ACD.
A.使用滤纸称量氢氧化钠固体 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水后定容时仰视刻度.
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 酒精、硫酸钡和水分别属于电解质、强电解质和弱电解质 | |
| C. | 胶体区别于其它分散系的本质特性是具有丁达尔现象 | |
| D. | 利用半透膜可除去淀粉溶液中的少量NaCl |
 “霾”是当今世界环境热点话题.某地空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
“霾”是当今世界环境热点话题.某地空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
 .
.