题目内容
5.下列物质的贮存方法不正确的是( )| A. | 液氯储存在钢瓶中 | B. | 液溴装入试剂瓶中应加少量水液封 | ||
| C. | 固体碘保存在CCl4中 | D. | 氢氟酸盛放在塑料瓶中 |
分析 A、常温下,氯气和铁在干燥情况下不反应;
B、液溴易挥发,且在水中溶解度不大;
C、碘易溶于四氯化碳;
D、HF能和玻璃的主要成分之一二氧化硅反应.
解答 解:A、常温下,氯气和铁在干燥情况下不反应,故液氯可以保存在钢瓶中,故A正确;
B、液溴易挥发,在水中溶解度不大,且密度比水大,故可以用水来储存溴,故B正确;
C、碘易溶于四氯化碳,故不能保存在四氯化碳溶于中,故C错误;
D、HF能和玻璃的主要成分之一二氧化硅反应,故HF不能保存在玻璃瓶中,只能保存在塑料瓶中,故D正确.
故选C.
点评 本题考查了常见的药品的储存,应注意理解药品储存的原理,避免死记硬背,难度不大,

练习册系列答案
相关题目
3.化学与生产、生活密切相关,下列对应关系正确的是( )
| 选项 | 性质 | 实际应用 |
| A | 活性炭可吸附水中的悬浮物 | 用于自来水的杀菌消毒 |
| B | SO2具有还原性 | 漂白纸浆 |
| C | 铁被氧气氧化时会放出热量 | 铁、活性炭、无机盐、水等的混合物制成暖宝贴 |
| D | 氧化铝是两性氧化物 | 作耐高温材料 |
| A. | A | B. | B | C. | C | D. | D |
13.下列物质的电离方程式正确的是( )
| A. | H2CO3═2H++CO32- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHCO3?Na++HCO3- | D. | Ba(OH)2═Ba2++2OH- |
20.NA是阿伏加德罗常数,下列说法一定正确的是( )
| A. | 5.6g铁与稀硝酸完全反应,转移的电子数为0.2NA | |
| B. | 标准状况下,22.4L氢气和22.4L氦气所含的质子数均为0.2NA | |
| C. | 100mL2mol•L-1 碳酸钠溶液中,CO32-数为0.2NA | |
| D. | 标准状况下,22.4LSO3所含原子数为3 NA |
10.向100mL 0.25mol•L-1的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是( )
| A. | 2.3 g | B. | 3.45 g | C. | 1.15 g | D. | 0.575 g |
17.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 含4mol HCl的浓盐酸与足量MnO2混合加热,转移电子数为2NA | |
| B. | 6.4gCu与过量硫粉反应,转移电子数为0.2NA | |
| C. | 通常状况下,112mL水中含有的电子数约为62.2NA | |
| D. | 标况下,2.24LSO3中含有0.1NA个SO3分子 |
14.下列各组离子在所给条件下能大量共存的是( )
| A. | 在含有大量Fe3+的溶液中:Na+,SCN-,SO42-,NO3- | |
| B. | 在pH=1的溶液中:Fe3+,Mg2+,Cl-,SO42- | |
| C. | 在加入了FeSO4•7H2O晶体溶液中:Na+,H+,Cl-,NO3- | |
| D. | 能使紫色石蕊试液变红的溶液中:K+,HCO3-,NO3-,S2- |
15.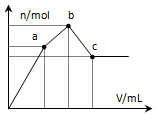 向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
 向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A. | a点的溶液呈中性 | |
| B. | 从开始到b点发生反应的总的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ | |
| C. | c点加入Ba(OH)2溶液的体积为200 mL | |
| D. | c点溶液呈碱性 |
 (1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.
(1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.