题目内容
8.几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )| 元素代号 | X | Y | Z | W | Q |
| 原子半径/pm | 160 | 143 | 70 | 66 | 102 |
| 主要化合价 | +2 | +3 | +5、-3 | -2 | +6、-2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 氢化物的沸点 H2W>H2Q |
分析 短周期元素中,W和Q的化合价都有-2价,为ⅥA族元素,Q的最高价为+6价,W无正价,则Q为S元素,W为O元素;Z有+5、-3价,处于VA族,原子半径小于S,与O的半径相差不大,故Z为N元素;X、Y分别为+2、+3价,分别处于ⅡA族、ⅢA族,原子半径X>Y>S,故X为Mg、Y为Al,结合元素周期律知识解答该题.
解答 解:短周期元素中,W和Q的化合价都有-2价,为ⅥA族元素,Q的最高价为+6价,W无正价,则Q为S元素,W为O元素;Z有+5、-3价,处于VA族,原子半径小于S,与O的半径相差不大,故Z为N元素;X、Y分别为+2、+3价,分别处于ⅡA族、ⅢA族,原子半径X>Y>S,故X为Mg、Y为Al.
A.同主族自左而右金属性减弱,故金属性Mg>Al,故A错误;
B.一定条件下,氮气与氧气反应生成NO,故B错误;
C.Y的最高价氧化物对应的水化物为氢氧化铝,不能溶于稀氨水,故C错误;
D.水分子之间形成氢键,而硫化氢分子之间为范德华力,氢化物的沸点 H2O>H2S,故D正确.
故选:D.
点评 本题考查结构性质位置关系应用,难度中等,根据元素的化合价与半径推断元素是解题的关键,注意元素周期律的理解掌握.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
18.下列叙述:①我国科学家在世界上第一次人工合成结晶牛胰岛素;②最早发现电子的是英国科学家道尔顿;③创造联合制减法的是我国著名科学家侯德榜;④首先制得氧气的是法国科学家拉瓦锡;⑤有机物的元素定量分析最早是由牛顿提出的,其中正确的是( )
| A. | 只有① | B. | ①和③ | C. | ①②③ | D. | ①②③④ |
3.下列有关说法中错误的是( )
| A. | CCl4可以由CH4制得,它可用于萃取碘水中的碘 | |
| B. | 相等的物质的量的乙烯和甲烷完全燃烧后产生的水的质量相同 | |
| C. | 用乙烯与HCl反应来制备氯乙烷比用乙烷与氯气反应更好 | |
| D. | 甲烷的空间构型是正四面体,所以二氯甲烷有两种不同的结构 |
13.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | 235U中的235表示该原子的相对原子质量 | |
| B. | HClO的结构式:H-Cl-O | |
| C. | 丙烷分子的比例模型: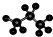 | |
| D. | 第三周期简单阴离子结构示意图均可表示为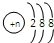 |
20.下列6个转化,其中不能通过一步反应实现的是( )
①SiO2→Na2SiO3 ②Fe(OH)2→Fe(OH)3 ③SiO2→H2SiO3
④Al2O3→Al(OH)3 ⑤Ca(OH)2→NaOH ⑥NaAlO2→AlCl3.
①SiO2→Na2SiO3 ②Fe(OH)2→Fe(OH)3 ③SiO2→H2SiO3
④Al2O3→Al(OH)3 ⑤Ca(OH)2→NaOH ⑥NaAlO2→AlCl3.
| A. | ①② | B. | ③④ | C. | ③④⑤ | D. | ⑤⑥ |
17.下列实验设计能达到相应实验目的是( )
| 选项 | 实验目的 | 实验设计 |
| A | 制备Fe(OH)3胶体 | 向0.1mol•L-1的FeCl3溶液中加入等体积0.3mol•L-1的NaOH溶液,煮沸 |
| B | 除去CO2中的HCl | 将混合气体依次通入Na2CO3溶液和浓硫酸中 |
| C | 检验溶液中是否含有SO42- | 取少量待检测溶液,向其中加入Ba(NO3)2溶液,再加入少量盐酸,观察实验现象 |
| D | 验证氧化性:Fe3+<Br2<Cl2 | 向试管中依次加入1mL0.1mol•L-1FeBr2溶液,几滴KSCN溶液和1mL苯,然后逐滴加入氯水,轻轻振荡,观察整个过程中有机相和水相中的现象 |
| A. | A | B. | B | C. | C | D. | D |
14.下列化学用语正确的是( )
| A. | 乙烯的实验式:C2H4 | B. | 四氯化碳分子的电子式为: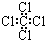 | ||
| C. | 聚丙烯的结构简式为: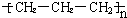 | D. | 异丁烷分子的键线式为: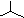 |
 ;
;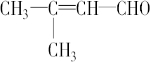 .
.