题目内容
15.以下说法正确的是( )| A. | 物质中化学键破坏了,一定发生了化学变化 | |
| B. | 水的沸点比硫化氢高,是因为水中的化学键比硫化氢中的化学键强 | |
| C. | 第三周期元素的离子半径逐渐变小 | |
| D. | 共价化合物中一定存在化学键 |
分析 A.化学变化指有新物质生成的变化,有化学键破坏的变化不一定属于化学变化,如NaCl溶于水,离子键被破坏,但无新物质生成;
B.水的沸点比硫化氢高是因为水能形成分子间氢键,使水的沸点反常的升高,而硫化氢不能;
C.电子层数越多,半径越大,相同电子层结构,原子序数越小半径越大;
D.共价化合物中一定有原子间的作用,一定存在化学键.
解答 解:A. 有化学键破坏的变化不一定属于化学变化,如NaCl溶于水,离子键被破坏,没有新物质生成,属于物理变化,故A正确;
B.水的沸点比硫化氢高是因为水能形成分子间氢键,使水的沸点反常的升高,而硫化氢没有分子间氢键,氢键不是化学键,故B错误;
C.电子层数越多,半径越大,相同电子层结构,原子序数越小半径越大,第三周期阴离子半径大于阳离子半径,故C错误;
D.共价化合物中一定有原子间的作用,一定存在化学键,故D正确.
故选:D.
点评 本题考查物理变化和化学变化、物质沸点高低的比较、微粒半径的大小比较、化学键类型,牢固理解概念是解题的关键,题目难度不大.

练习册系列答案
相关题目
5.二氧化锰是常用的催化剂、氧化剂和活性电极材料.海底蕴藏着丰富的锰结核矿,其主要成分是MnO2.1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如图所示:
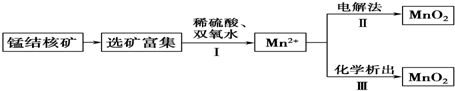
已知:反应Ⅱ以石墨为电极,电解硫酸锰溶液制二氧化锰;反应Ⅲ可以是高锰酸钾氧化硫酸锰,也可以是氯酸钾氧化硫酸锰.下列推断不正确的是( )

已知:反应Ⅱ以石墨为电极,电解硫酸锰溶液制二氧化锰;反应Ⅲ可以是高锰酸钾氧化硫酸锰,也可以是氯酸钾氧化硫酸锰.下列推断不正确的是( )
| A. | 反应Ⅰ的离子方程式为MnO2+H2O2+2H+═Mn2++2H2O+O2↑ | |
| B. | 反应Ⅱ中阴极反应式为Mn2+-2e-+2H2O═MnO2↓+4H+ | |
| C. | 若加入KClO3,则反应Ⅲ为2ClO3-+5Mn2++4H2O═5MnO2↓+Cl2↑+8H+ | |
| D. | 若加入KMnO4,则反应Ⅲ为3Mn2++2MnO4-+2H2O═5MnO2↓+4H+ |
6.下列说法正确的是( )
| A. | 电解MgCl2饱和溶液,可制得金属镁 | |
| B. | 镀锡铁制品和镀锌铁制品的镀层破损时,镀锡铁中铁的腐蚀速率更快 | |
| C. | 在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫牺牲阳极的阴极保护法 | |
| D. | 不锈钢有较强的抗腐蚀能力是因为在钢铁表面镀上了铬 |
3.下列有关说法中错误的是( )
| A. | CCl4可以由CH4制得,它可用于萃取碘水中的碘 | |
| B. | 相等的物质的量的乙烯和甲烷完全燃烧后产生的水的质量相同 | |
| C. | 用乙烯与HCl反应来制备氯乙烷比用乙烷与氯气反应更好 | |
| D. | 甲烷的空间构型是正四面体,所以二氯甲烷有两种不同的结构 |

 (或
(或
 ).
).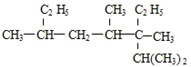 2,3,4,6-四甲基-3-乙基辛烷
2,3,4,6-四甲基-3-乙基辛烷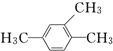 1,2,4-三甲苯
1,2,4-三甲苯