题目内容
10.下列叙述中,正确的是( )①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程中镀层金属应该放在阳极.
| A. | ①②③④ | B. | ③④ | C. | ③④⑤ | D. | ④ |
分析 ①电解池是将电能转变成化学能的装置;
②原电池是将化学能转变成电能的装置;
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化,发生电能和化学能的转化;
④不能自发进行的氧化还原反应,通过电解的原理有可能实现,如铜和稀硫酸的反应;
⑤电镀时镀层金属在阳极失电子.
解答 解:①电解池是将电能转变成化学能的装置,故①错误;
②原电池是将化学能转变成电能的装置,故②错误;
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化,发生电能和化学能的转化,一定发生化学变化,故③正确;
④不能自发进行的氧化还原反应,通过电解的原理有可能实现,如铜和稀硫酸的反应,铜为阳极被氧化,可生成硫酸铜,故④正确;
⑤电镀时镀层金属在阳极失电子,金属阳离子在阴极得电子析出金属,故⑤正确.
故选C.
点评 本题考查较为综合,涉及电解池和原电池知识,难度不大,注意把握原电池和电解池的工作原理,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
20.钠及其化合物具有广泛的用途.
(1)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如表;
上述盐溶液中,结合H+能力最强的阴离子是CO32-,根据表中数据,浓度均为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填编号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)实验室中常用NaOH来进行洗气和提纯.
①当300mL 1mol•L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+).
②几种离子开始沉淀时的pH如表:
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,Cu2+(填离子符号)先沉淀,KSP[Fe(OH)2]<KSP[Mg(OH)2](填“>”、“=”或“<”).
(1)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)实验室中常用NaOH来进行洗气和提纯.
①当300mL 1mol•L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+).
②几种离子开始沉淀时的pH如表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
1.当有机物分子中的一个碳原子所连四个原子或原子团均不相同时,此碳原子就是“手性碳原子”,具有手性碳原子的物质存在对映异构体,如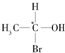 等,则下列化合物中存在对映异构体的是( )
等,则下列化合物中存在对映异构体的是( )
 等,则下列化合物中存在对映异构体的是( )
等,则下列化合物中存在对映异构体的是( )| A. | CH3COOH | B. | CH3COCH3 | ||
| C. | 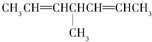 | D. | 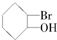 |
18.下列叙述:①我国科学家在世界上第一次人工合成结晶牛胰岛素;②最早发现电子的是英国科学家道尔顿;③创造联合制减法的是我国著名科学家侯德榜;④首先制得氧气的是法国科学家拉瓦锡;⑤有机物的元素定量分析最早是由牛顿提出的,其中正确的是( )
| A. | 只有① | B. | ①和③ | C. | ①②③ | D. | ①②③④ |
5.二氧化锰是常用的催化剂、氧化剂和活性电极材料.海底蕴藏着丰富的锰结核矿,其主要成分是MnO2.1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如图所示:
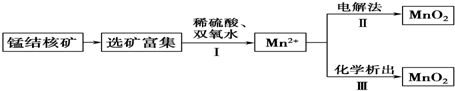
已知:反应Ⅱ以石墨为电极,电解硫酸锰溶液制二氧化锰;反应Ⅲ可以是高锰酸钾氧化硫酸锰,也可以是氯酸钾氧化硫酸锰.下列推断不正确的是( )

已知:反应Ⅱ以石墨为电极,电解硫酸锰溶液制二氧化锰;反应Ⅲ可以是高锰酸钾氧化硫酸锰,也可以是氯酸钾氧化硫酸锰.下列推断不正确的是( )
| A. | 反应Ⅰ的离子方程式为MnO2+H2O2+2H+═Mn2++2H2O+O2↑ | |
| B. | 反应Ⅱ中阴极反应式为Mn2+-2e-+2H2O═MnO2↓+4H+ | |
| C. | 若加入KClO3,则反应Ⅲ为2ClO3-+5Mn2++4H2O═5MnO2↓+Cl2↑+8H+ | |
| D. | 若加入KMnO4,则反应Ⅲ为3Mn2++2MnO4-+2H2O═5MnO2↓+4H+ |
15.下列各装置能构成原电池的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
2.某有机物的结构如图所示,它不可能具有的性质是( )


| A. | 能跟NaOH溶液反应 | B. | 能使酸性KMnO4溶液褪色 | ||
| C. | 呈碱性 | D. | 能发生酯化反应 |