题目内容
5.工业上以N2、H2为原料制取硝酸铵的流程如图所示.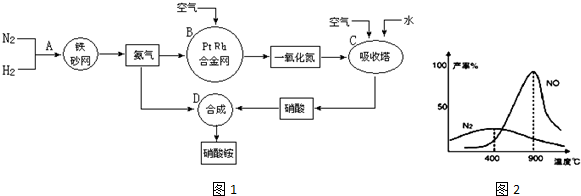
回答下列问题:
(1)氨合成塔适宜的压强是20~50MPa,如果压强过大,除对设备要求高外,还会导致的结果是压碎催化剂,缩短催化剂寿命.
(2)合成硝酸的吸收塔内填充瓷环,其作用是增大气液接触面积,吸收塔中还需补充空气的目的是可使NO全部转化成HNO3.
(3)若输送NH3的管道某处发生泄漏,检测的简单方法为用湿润的红色石蕊试纸检测,试纸变蓝的位置即是氨气泄漏处.
(4)在一定温度和压强的密闭容器中,将物质的量之比为3:2的H2和N2混合,当该反应达到平衡时,测出平衡混合气中氨的体积分数为25%,此时H2的转化率为50%.
(5)制硝酸氧化炉中氨气和氧气在145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图所示).温度较低时以生成N2为主,900℃时发生主要反应的化学方程式为4NH3+5O2
 4NO+6H2O,当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度转化率下降.
4NO+6H2O,当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度转化率下降.(6)若N2、H2合成氨时,H2的转化率为60%,NH3催化氧化制HNO3时的损失20%的氨,其它环节的损失忽略不计.则10tH2最多可以制取71.1t硝酸铵.
分析 (1)氨合成反应是气体体积减小的放热反应,在氨合成塔适宜的压强是20~50MPa,如果压强过大,除对设备要求高外,还会导致的结果是压碎催化剂,缩短催化剂寿命;
(2)合成硝酸的吸收塔内填充瓷环,其作用是增大气液接触面积,吸收塔中还需补充空气的目的是可使NO全部转化成HNO3;
(3)若输送NH3的管道某处发生泄漏,由于氨气的水溶液显碱性,会使湿润的红色石蕊试纸变为蓝色,所以用湿润的红色石蕊试纸检测;
(4)在一定温度和压强的密闭容器中,将物质的量之比为3:2的H2和N2混合,当该反应达到平衡时,测出平衡混合气中氨的体积分数为25%,假设反应的N2的体积是x,则反应的氢气的体积是3x,反应产生的NH3的体积是2x,按照三段法计算转化率;
(5)制硝酸氧化炉中氨气和氧气在145℃就开始反应,在不同温度和催化剂条件下生成不同产物,根据图示可知,在温度较低时以生成N2为主,900℃时氨气被氧化产生NO,发生主要反应的化学方程式为4NH3+5O2 4NO+6H2O;当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度,化学平衡向吸热的逆反应方向移动,使反应物NH3转化率下降;
4NO+6H2O;当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度,化学平衡向吸热的逆反应方向移动,使反应物NH3转化率下降;
(6)N2、H2合成氨时,N2+3H2 2NH3,根据上述分析利用化学方程式计量数计算,详细见解答.
2NH3,根据上述分析利用化学方程式计量数计算,详细见解答.
解答 解:(1)氨合成反应是气体体积减小的放热反应,在氨合成塔适宜的压强是20~50MPa,如果压强过大,除对设备要求高外,还会导致的结果是压碎催化剂,缩短催化剂寿命,
故答案为:压碎催化剂,缩短催化剂寿命;
(2)合成硝酸的吸收塔内填充瓷环,其作用是增大气液接触面积,吸收塔中还需补充空气的目的是可使NO全部转化成HNO3,
故答案为:增大气液接触面积;可使NO全部转化成HNO3;
(3)若输送NH3的管道某处发生泄漏,由于氨气的水溶液显碱性,会使湿润的红色石蕊试纸变为蓝色,所以用湿润的红色石蕊试纸检测,试纸变蓝的位置即是氨气泄漏处,
故答案为:用湿润的红色石蕊试纸检测,试纸变蓝的位置即是氨气泄漏处;
(4)在一定温度和压强的密闭容器中,将物质的量之比为3:2的H2和N2混合,当该反应达到平衡时,测出平衡混合气中氨的体积分数为25%,假设反应的N2的体积是x,则反应的氢气的体积是3x,反应产生的NH3的体积是2x,此时H2的物质的量是(3-3x),N2是(2-x),所以2x÷[2x+(3-3x)+(2-x)]=25%,解得x=0.5,所以此时H2的转化率为(3×0.5)÷3=50%,
故答案为:50%;
(5)制硝酸氧化炉中氨气和氧气在145℃就开始反应,在不同温度和催化剂条件下生成不同产物,根据图示可知,在温度较低时以生成N2为主,900℃时氨气被氧化产生NO,发生主要反应的化学方程式为4NH3+5O2 4NO+6H2O;当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度,化学平衡向吸热的逆反应方向移动,使反应物NH3转化率下降,
4NO+6H2O;当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度,化学平衡向吸热的逆反应方向移动,使反应物NH3转化率下降,
故答案为:N2;4NH3+5O2 4NO+6H2O;
4NO+6H2O;
(6)N2、H2合成氨时,N2+3H2 2NH3;H2的转化率为60%,10tH2的物质的量是n(H2)=5×106mol;合成氨气的物质的量是n(NH3)=5×106mol×60%×2/3=2×106mol;假设用于催化氧化制HNO3的氨的物质的量是x,由于氨的损失20%,所以产生的硝酸的物质的量是(1-20%)x,与硝酸反应的氨的物质的量是(1-20%)x,(1-20%)x+x=2×106mol,x=1.11×106mol,反应产生的硝酸铵的质量是m(NH4NO3)=(1-20%)x×80g/mol=1.11×106mol×80%×80g/mol=71.1×106g=71.1吨,
2NH3;H2的转化率为60%,10tH2的物质的量是n(H2)=5×106mol;合成氨气的物质的量是n(NH3)=5×106mol×60%×2/3=2×106mol;假设用于催化氧化制HNO3的氨的物质的量是x,由于氨的损失20%,所以产生的硝酸的物质的量是(1-20%)x,与硝酸反应的氨的物质的量是(1-20%)x,(1-20%)x+x=2×106mol,x=1.11×106mol,反应产生的硝酸铵的质量是m(NH4NO3)=(1-20%)x×80g/mol=1.11×106mol×80%×80g/mol=71.1×106g=71.1吨,
故答案为:71.1.
点评 本题主要考查了工业合成氨与制备硝酸,同时考查了化学平衡计算,综合性较强,难度较大,正确理解各物质之间的反应是解题的关键,对学生分析问题和解决问题的能力要求较高.

①SiO2→Na2SiO3 ②Fe(OH)2→Fe(OH)3 ③SiO2→H2SiO3
④Al2O3→Al(OH)3 ⑤Ca(OH)2→NaOH ⑥NaAlO2→AlCl3.
| A. | ①② | B. | ③④ | C. | ③④⑤ | D. | ⑤⑥ |
| 选项 | 实验目的 | 实验设计 |
| A | 制备Fe(OH)3胶体 | 向0.1mol•L-1的FeCl3溶液中加入等体积0.3mol•L-1的NaOH溶液,煮沸 |
| B | 除去CO2中的HCl | 将混合气体依次通入Na2CO3溶液和浓硫酸中 |
| C | 检验溶液中是否含有SO42- | 取少量待检测溶液,向其中加入Ba(NO3)2溶液,再加入少量盐酸,观察实验现象 |
| D | 验证氧化性:Fe3+<Br2<Cl2 | 向试管中依次加入1mL0.1mol•L-1FeBr2溶液,几滴KSCN溶液和1mL苯,然后逐滴加入氯水,轻轻振荡,观察整个过程中有机相和水相中的现象 |
| A. | A | B. | B | C. | C | D. | D |
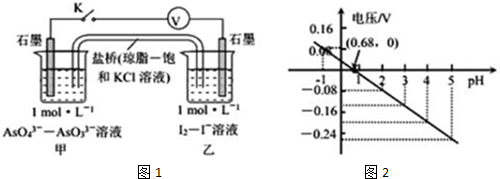
| A. | pH>0.68时,甲烧杯中石墨为负极 | |
| B. | pH=0.68时,反应处于平衡状态 | |
| C. | pH<0.68时,氧化性I2<AsO43- | |
| D. | pH=5时,负极电极反应式为2I--2e-=I2 |
| A. | 乙烯的实验式:C2H4 | B. | 四氯化碳分子的电子式为: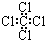 | ||
| C. | 聚丙烯的结构简式为: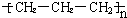 | D. | 异丁烷分子的键线式为: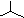 |