题目内容
4.将3.2g铜与30mL10mol/L的硝酸充分反应,还原产物为NO2和NO,反应后溶液中含a mol H+,则此时溶液中所含NO3-的物质的量为( )| A. | 0.1a mol | B. | (0.1+a)mol | C. | (0.05+a)mol | D. | 2a mol |
分析 铜与过量硝酸反应,反应后溶液中的溶质是硝酸和硝酸铜,根据硝酸中NO3-和H+、硝酸铜中NO3-和Cu2+的关系式,由H+、Cu2+的量计算NO3-的物质的量.
解答 解:3.2g的物质的量为:$\frac{3.2g}{64g/mol}$=0.05mol,
设Cu2+对应的NO3-为xmol,
H+对应的NO3-为ymol,
Cu(NO3)2-Cu2+-Cu-2NO3-
1 2
0.05mol x
则:$\frac{1}{0.05mol}$=$\frac{2}{x}$,
解得:x=0.1mol,
HNO3-H+-NO3-
1 1
amol ymol
则:y=amol,
则此时溶液中含有NO3-的物质的量为:(0.1+a)mol,
故选B.
点评 本题考查的是硝酸的性质及守恒法的计算,为高频考点,题目难度中等,把握原子守恒的计算为解答的关键,在做题时要灵活运用,不能生搬硬套,侧重分析与计算能力的考查.

练习册系列答案
相关题目
14.采用软锰矿浆(主要成分为Mn02,还含有Fe2O3、FeO、NiO、CoO等杂质)对工业烟气脱硫是工业生产中的一项新技术,该技术在脱硫的过程中还可以生产金属锰及化学肥料.该工艺流程如下图:
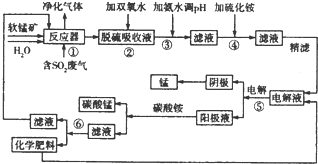
部分金属离子沉淀时的PH如下表:
回答下列问题:
(1)步骤①的反应器为“喷射鼓泡反应器,即将高速废气流通入到一定液固比的软锰矿浆中,并不断搅拌,采用这种设备的好处是增大二氧化硫与二氧化锰的接触面积,使其充分反应,从而提高反应速率,该反应的还原产物为亚铁离子、锰离子.
(2)写出步骤②中反应的离子方程式:2Fe2++2H++H2O2=2Fe3++2H2O
(3)若步骤③调节pH使用的是NaOH溶液,则导致的后果是后续得到有化学肥料中含有硫酸钠杂质.
(4)步骤④加入(NH4)2S的目的是除去溶液中的Ni2+、Co2+,加入(NH4)2S时溶液的pH最好控制在6.0以下,原因是防止锰离子生成硫化锰沉淀.
(5)步骤⑤所用设备名称为电解槽.
(6)步骤⑥的化学肥料为硫酸铵,该肥料加入到步骤⑤中的作用是增加溶液的导电性.

部分金属离子沉淀时的PH如下表:
| 阳离子 | Fe2+ | Fe3+ | Mn2+ | Ni2+ | Co2+ | |
| 氢氧化物沉淀 | 开始沉淀的PH | 7.5 | 2.2 | 8.8 | 6.4 | 9.0 |
| 完全沉淀的PH | 9.5 | 3.5 | 10.8 | 8.4 | ||
| 硫化物沉淀 | 开始沉淀的PH | 6.2 | 4.67 | |||
| 完全沉淀的PH | ||||||
(1)步骤①的反应器为“喷射鼓泡反应器,即将高速废气流通入到一定液固比的软锰矿浆中,并不断搅拌,采用这种设备的好处是增大二氧化硫与二氧化锰的接触面积,使其充分反应,从而提高反应速率,该反应的还原产物为亚铁离子、锰离子.
(2)写出步骤②中反应的离子方程式:2Fe2++2H++H2O2=2Fe3++2H2O
(3)若步骤③调节pH使用的是NaOH溶液,则导致的后果是后续得到有化学肥料中含有硫酸钠杂质.
(4)步骤④加入(NH4)2S的目的是除去溶液中的Ni2+、Co2+,加入(NH4)2S时溶液的pH最好控制在6.0以下,原因是防止锰离子生成硫化锰沉淀.
(5)步骤⑤所用设备名称为电解槽.
(6)步骤⑥的化学肥料为硫酸铵,该肥料加入到步骤⑤中的作用是增加溶液的导电性.
12.X、Y、Z、W、R属于短周期主族元素,X的金属性在短周期种最强,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述正确的是( )
| A. | X与Y形成的两种化合物中阴、阳离子的个数比均为2:1 | |
| B. | Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低 | |
| C. | Z、W、R最高价氧化物对应水化物的酸性强弱顺序:R>W>Z | |
| D. | Y分别与Z、W、R以两种元素组成的常见化合物有3种 |
19.下列有关物质性质的应用正确的是( )
| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| C. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| D. | SO2和Cl2都有漂白作用,将等物质的量的两种气体同时作用于潮湿的有色物质时,可增强漂白作用 |
16.同温同压下,等体积的两个密闭容器中分别充满12C18O和14N2两种气体,下列说法正确的是( )
| A. | 分子数和质量分别不等 | B. | 质子数相等,质量不等 | ||
| C. | 分子数和质量都相等 | D. | 原子数、中子数和质子数都相等 |
13.某有机物结构简式为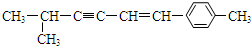 ,关于该有机物的空间构型下列说法中正确的是( )
,关于该有机物的空间构型下列说法中正确的是( )
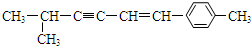 ,关于该有机物的空间构型下列说法中正确的是( )
,关于该有机物的空间构型下列说法中正确的是( )| A. | 该分子中所有的碳原子均可能处于同一平面上 | |
| B. | 该分子中一定共面的碳原子数至少为8个 | |
| C. | 该分子中至少有9个碳原子处于同一条直线上 | |
| D. | 该分子中可能处于同一平面的原子总数最多为16个 |

 △H=+88.6kJ•mol-1
△H=+88.6kJ•mol-1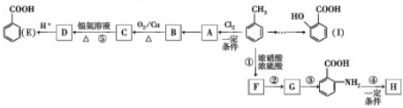
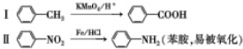
 .
. .写出③的转化关系
.写出③的转化关系 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (用已知中的表达式表示,不用写化学方程式)
(用已知中的表达式表示,不用写化学方程式)