题目内容
19.下列有关物质性质的应用正确的是( )| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| C. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| D. | SO2和Cl2都有漂白作用,将等物质的量的两种气体同时作用于潮湿的有色物质时,可增强漂白作用 |
分析 A.氯气与水反应生成氯化氢、次氯酸;
B.液氨汽化需要吸收大量的热,具有制冷作用;
C.二氧化硅与氢氟酸反应生成四氟化硅和水;
D.等物质的量的两种气体,反应生成硫酸和盐酸.
解答 解:A.氯气与水反应生成氯化氢、次氯酸,反应中氯气既做氧化剂又做还原剂,故A错误;
B.液氨汽化需要吸收大量的热,具有制冷作用,常用作制冷剂,故B正确;
C.二氧化硅与氢氟酸反应生成四氟化硅和水,所以氢氟酸能够腐蚀石英器皿,故C错误;
D.等物质的量的两种气体,反应生成硫酸和盐酸,盐酸与硫酸都不具有漂白性,故D错误;
故选;B.
点评 本题考查了元素化合物知识,明确氯气、液氨、二氧化硅、二氧化硫的性质是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.甲学生对Cl2和FeCl2和KSCN混合溶液的反应进行实验探究.
(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(2)A中溶液变红的原因是(用离子方程式表示)2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.
甲同学的实验证明产生现象II的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为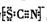 .
.
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②通过实验证明了SCN- 中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
③若SCN-与Cl2反应生成1molCO2,则转移电子的物质的量是16mol.
| 操作 | 现象 |
通入氯气至过量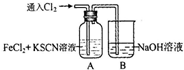 | Ⅰ、A中溶液变红 Ⅱ、稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是(用离子方程式表示)2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.
甲同学的实验证明产生现象II的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为
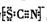 .
.①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②通过实验证明了SCN- 中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
③若SCN-与Cl2反应生成1molCO2,则转移电子的物质的量是16mol.
10.下列各组性质比较中,不正确的是( )
| A. | 元素最高化合价:Al>Mg | B. | 金属性:Al>Mg | ||
| C. | 酸性:H2SO4>H3PO4 | D. | 稳定性:HF>HCl |
7.化学与人类生活密切相关,下列说法不正确的是( )
| A. | 化学可以识别、改变和创造分子 | |
| B. | 金刚石常用作砂纸、砂轮的磨料 | |
| C. | 氧化铁常用作红色油漆和涂料 | |
| D. | 葡萄糖可用于合成补钙药物及维生素C(结构如图) |
14.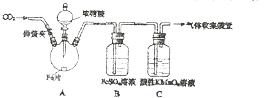 甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.
甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.
文献记载:Ⅰ.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,气生成的产物有有+4、+2、-3价等氮的化合物.
Ⅱ.FeSO4+NO?Fe(NO)SO4(棕色)△H<0
Ⅲ.NO2和NO都能被KMnO4氧化吸收
甲的实验操作和现象记录如下:
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生.
(2)检验是否生成-3价氮的化合物,应进行的实验操作是取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口.若试纸变蓝,则A中生成NH4+.
(3)甲取少量B中溶液,加热,实验现象是棕色溶液变浅(或绿),无色气体逸出,且在空气中变为红棕色.甲依据该现象得出的结论是A中有NO生成.请用化学平衡原料解释原因:FeSO4+NO?Fe(NO)SO4(棕色)△H<0正反应放热,加热后,平衡向逆反应方向移动.
(4)乙认为甲得出A中有NO生成的证据不足.为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是浓硝酸换成稀硝酸,此时A中首先发生反应的离子方程式是Fe+4H++NO3-═Fe3++NO↑+2H2O,证明有NO生成的实验现象是A中没有红棕色气体生成,B中溶液变为棕色.
(5)证明A溶液中是否含有Fe2+和Fe3+,选择的药品是(填序号)cd.
a.铁粉 b.溴水 c.铁氰化钾溶液 d.硫氰化钾溶液.
 甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.
甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.文献记载:Ⅰ.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,气生成的产物有有+4、+2、-3价等氮的化合物.
Ⅱ.FeSO4+NO?Fe(NO)SO4(棕色)△H<0
Ⅲ.NO2和NO都能被KMnO4氧化吸收
甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | / |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余 |
(1)滴入浓硝酸加热前没有明显现象的原因是常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生.
(2)检验是否生成-3价氮的化合物,应进行的实验操作是取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口.若试纸变蓝,则A中生成NH4+.
(3)甲取少量B中溶液,加热,实验现象是棕色溶液变浅(或绿),无色气体逸出,且在空气中变为红棕色.甲依据该现象得出的结论是A中有NO生成.请用化学平衡原料解释原因:FeSO4+NO?Fe(NO)SO4(棕色)△H<0正反应放热,加热后,平衡向逆反应方向移动.
(4)乙认为甲得出A中有NO生成的证据不足.为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是浓硝酸换成稀硝酸,此时A中首先发生反应的离子方程式是Fe+4H++NO3-═Fe3++NO↑+2H2O,证明有NO生成的实验现象是A中没有红棕色气体生成,B中溶液变为棕色.
(5)证明A溶液中是否含有Fe2+和Fe3+,选择的药品是(填序号)cd.
a.铁粉 b.溴水 c.铁氰化钾溶液 d.硫氰化钾溶液.
4.将3.2g铜与30mL10mol/L的硝酸充分反应,还原产物为NO2和NO,反应后溶液中含a mol H+,则此时溶液中所含NO3-的物质的量为( )
| A. | 0.1a mol | B. | (0.1+a)mol | C. | (0.05+a)mol | D. | 2a mol |
8.下列化学反应的有机生成物为纯净物的是( )
| A. | CH4和Cl2光照发生取代反应 | |
| B. | 1,3丁二烯与等物质的量的溴发生反应 | |
| C. | CH3CH(OH)CH2CH3在浓硫酸作用下加热的反应 | |
| D. | 乙烯和氯化氢加成 |
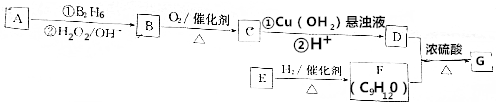
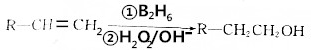
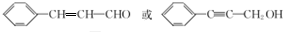 .
.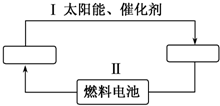 能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.
能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.