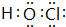题目内容
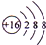
15.回答下列问题:(1)下图为四种粒子的结构示意图,完成以下填空:

属于阳离子结构的粒子是B(填字母序号,下同);A粒子的半径>B粒子的半径(填“>”、“<”或“=”).
(2)有机物M经过太阳光光照可转化成N,转化过程如下:
 △H=+88.6kJ•mol-1
△H=+88.6kJ•mol-1则M、N相比,较稳定的是M.
(3)由氢气和氧气反应生成1mol水蒸气放出热量241.8kJ,写出该反应的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol.
(4)一定温度下在某定容容器中发生反应:2A(g)+3B(g)?2C(g),开始时,A的浓度为2mol•L-1,B的浓度为4mol•L-1,2min后,A的浓度减少0.8mol•L-1,则
①v(B)=0.6 mol•L -1•min-1,v(C)=0.4 mol•L -1•min-1.
②在2min末,C的浓度是0.8 mol/L,B的浓度是2.8 mol/L.
分析 (1)因为阳离子的核内质子数>核外电子数,所以可知图中哪种粒子为阳离子;AB粒子为不同种元素的微粒,电子层相同,而核电荷数越大,半径越小;
(2)依据转化过程中M、N的能量高低分析判断,能量越高越活泼;
(3)根据热化学方程式的书写原则写出氢气燃烧生成气态水的热化学方程式,方程中的热量和化学计量数要对应;
(4)①根据v=$\frac{△c}{△t}$计算出v(A),然后根据速率之比等于化学计量数之比计算;
②由△C=v•△t计算出2min内△c(C)、△c(B)的大小分析.
解答 解:(1)因为阳离子的核内质子数>核外电子数,故B为阳离子;A、B粒子为不同种元素的微粒,电子层相同,而核电荷数越大,半径越小,故B的半径小于A,故答案为:B;>;
(2)转化过程是吸热反应,故M的能量低于N,而物质的能量越低物质越稳定,故说明M稳定,故答案为:M;
(3)氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol;
(4)①v(A)=$\frac{0.8mol/L}{2min}$=0.4mol•L -1•min-1,根据速率之比等于化学计量数之比可得:v(B)=$\frac{3}{2}$v(A)=$\frac{3}{2}$×0.4mol•L -1•min-1=0.6 mol•L -1•min-1;
v(C)=v(A)×$\frac{3}{2}$=0.4 mol•L -1•min-1;
故答案为:0.6 mol•L -1•min-1;0.4 mol•L -1•min-1;
②△c(C)=0.4 mol•L -1•min-1×2min=0.8mol/L,则2min末C的浓度为0+0.8mol/L=0.8mol/L;△c(B)=2min×0.6 mol•L -1•min-1=1.2mol/L,则2min末B的浓度为4mol/L-1.2mol/L=2.8mol/L,即c(C)=0.8 mol/L,c(B)=2.8 mol/L.
故答案为:0.8 mol/L;2.8 mol/L.
点评 本题考查了化学反应速率的计算,题目难度一般,注意化学反应速率计算公式、速率之比等于化学计量数之比的应用.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案| A. | 平衡前,随着反应的进行,容器内压强变小 | |
| B. | 平衡时,其他条件不变,分离出H2O(g),逆反应速率减小 | |
| C. | 平衡时,其他条件不变,升高温度平衡常数增大 | |
| D. | 其他条件不变,使用不同催化剂,HCl(g)的转化率不变 |
| A. | 铝的第一电离能比镁的第一电离能大 | |
| B. | 钾的第一电离能比镁的第一电离能大 | |
| C. | 在所有的元素中,F的第一电离能最大 | |
| D. | 第3周期所含元素中钠的第一电离能最小 |
| A. | 元素最高化合价:Al>Mg | B. | 金属性:Al>Mg | ||
| C. | 酸性:H2SO4>H3PO4 | D. | 稳定性:HF>HCl |
| A. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 | |
| B. | 乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| D. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同 |
| A. | 化学可以识别、改变和创造分子 | |
| B. | 金刚石常用作砂纸、砂轮的磨料 | |
| C. | 氧化铁常用作红色油漆和涂料 | |
| D. | 葡萄糖可用于合成补钙药物及维生素C(结构如图) |
| A. | 0.1a mol | B. | (0.1+a)mol | C. | (0.05+a)mol | D. | 2a mol |
(Ⅰ) I2(g)+H2(g)═2HI(g)△H=-9.48KJ/mol
(Ⅱ) I2(s)+H2(g)═2HI(g)△H=+26.48KJ/mol
下列判断正确的是( )
| A. | 物质的量相同时,反应(Ⅰ)的反应物总能量比反应(Ⅱ)的反应物总能量高 | |
| B. | 反应(Ⅰ)和反应(Ⅱ)均为放热反应 | |
| C. | 反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定 | |
| D. | 1mol H2(g)通入1mol I2中在该条件下反应的反应放热为9.48 kJ |