题目内容
13.某有机物结构简式为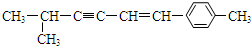 ,关于该有机物的空间构型下列说法中正确的是( )
,关于该有机物的空间构型下列说法中正确的是( )| A. | 该分子中所有的碳原子均可能处于同一平面上 | |
| B. | 该分子中一定共面的碳原子数至少为8个 | |
| C. | 该分子中至少有9个碳原子处于同一条直线上 | |
| D. | 该分子中可能处于同一平面的原子总数最多为16个 |
分析 有机物中的原子共平面问题可以直接联想甲烷的正四面体结构、乙烯的平面型结构、乙炔的直线型结构和苯的平面型结构,对有机物进行肢解,分部分析,另外要重点掌握碳碳单键可旋转、双键和三键不可旋转,据此解即可.
解答 解:A.此有机物中存在的C原子如图所示,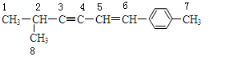 ,其中与2号碳相连的3和1、8这3个碳原子为四面体结构,不可能在同一平面上,故A错误;
,其中与2号碳相连的3和1、8这3个碳原子为四面体结构,不可能在同一平面上,故A错误;
B.该分子中,碳碳三键中的3、4号碳与双键中5、6号碳一定在同一平面上,与3号碳相连的2号碳一定在这个平面内,与6号碳相连的苯环上的碳以及其对面上的碳和7号碳一定在同一平面内,故最少在同一平面内的碳原子数是8,故B正确;
C.乙炔中所有原子共直线,故最多有4个原子在一条直线上,故C错误;
D.其中甲基中最多有2个H原子与甲基所在碳的共平面,即2、3、4、5、6、7号碳以及苯环所在的原子在同一平面内,那么187号上最多有1个H在此平面内,总共有30个原子,最多有24个原子共平面,故D错误,故选B.
点评 本题主要考查的是常见有机化合物的结构,难度不大,掌握乙烯乙炔、甲烷以及苯的结构是解决本题的关键.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
4.将3.2g铜与30mL10mol/L的硝酸充分反应,还原产物为NO2和NO,反应后溶液中含a mol H+,则此时溶液中所含NO3-的物质的量为( )
| A. | 0.1a mol | B. | (0.1+a)mol | C. | (0.05+a)mol | D. | 2a mol |
8.下列化学反应的有机生成物为纯净物的是( )
| A. | CH4和Cl2光照发生取代反应 | |
| B. | 1,3丁二烯与等物质的量的溴发生反应 | |
| C. | CH3CH(OH)CH2CH3在浓硫酸作用下加热的反应 | |
| D. | 乙烯和氯化氢加成 |
5.碘与氢气一定条件下反应的热化学方程式如下
(Ⅰ) I2(g)+H2(g)═2HI(g)△H=-9.48KJ/mol
(Ⅱ) I2(s)+H2(g)═2HI(g)△H=+26.48KJ/mol
下列判断正确的是( )
(Ⅰ) I2(g)+H2(g)═2HI(g)△H=-9.48KJ/mol
(Ⅱ) I2(s)+H2(g)═2HI(g)△H=+26.48KJ/mol
下列判断正确的是( )
| A. | 物质的量相同时,反应(Ⅰ)的反应物总能量比反应(Ⅱ)的反应物总能量高 | |
| B. | 反应(Ⅰ)和反应(Ⅱ)均为放热反应 | |
| C. | 反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定 | |
| D. | 1mol H2(g)通入1mol I2中在该条件下反应的反应放热为9.48 kJ |
2.下列关于反应“化合物甲+单质A$\stackrel{一定条件}{→}$化合物乙+单质B”的说法正确的是( )
| A. | 反应在水溶液中进行时,若A为金属,则B一定是金属 | |
| B. | 反应在水溶液中进行时,若A为非金属,则B一定是非金属 | |
| C. | 反应在加热或高温下进行时,若A为金属,则B一定是非金属 | |
| D. | 反应在加热或高温下进行时,若A为非金属,则B一定是金属 |
7.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm)
(1)A和E两元素组成的化合物的电子式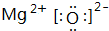 .
.
(2)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为:Al(OH)3+3H+=Al3+3H2O
(3)上述五种元素的最高价氧化物对应水化物的酸性最强的是HClO4(填化学式)
(4)C和E形成的化合物中具有还原性的是SO2(填化学式).
(5)A和D所形成化合物的晶体类型:离子晶体.
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
 .
.(2)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为:Al(OH)3+3H+=Al3+3H2O
(3)上述五种元素的最高价氧化物对应水化物的酸性最强的是HClO4(填化学式)
(4)C和E形成的化合物中具有还原性的是SO2(填化学式).
(5)A和D所形成化合物的晶体类型:离子晶体.
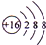
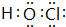
 ;(2)NaOH
;(2)NaOH ;(3)HClO
;(3)HClO ;(4)H2O2
;(4)H2O2 .
.


