题目内容
12.X、Y、Z、W、R属于短周期主族元素,X的金属性在短周期种最强,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述正确的是( )| A. | X与Y形成的两种化合物中阴、阳离子的个数比均为2:1 | |
| B. | Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低 | |
| C. | Z、W、R最高价氧化物对应水化物的酸性强弱顺序:R>W>Z | |
| D. | Y分别与Z、W、R以两种元素组成的常见化合物有3种 |
分析 X的原子半径在短周期主旋元素中最大,应为Na元素;Y元素的原子外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,因为L层电子最多为8,则n=2,m=6,所以Y为O元素,Z为Si元素;W元素与Z元素同主族,应为C元素;R元素原子与Y元素原子的核外电子数之比为2:1,Y的核外电子数为8,则R的核外电子数为16,应为S元素,结合元素对应单质、化合物的性质以及元素周期律可解答该题.
解答 解:X的原子半径在短周期主旋元素中最大,应为Na元素;Y元素的原子外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,因为L层电子最多为8,则n=2,m=6,所以Y为O元素,Z为Si元素,W元素与Z元素同主族,应为C元素,R元素原子与Y元素原子的核外电子数之比为2:1,Y的核外电子数为8,则R的核外电子数为16,应为S元素,
A.X与Y形成的两种化合物分别为Na2O、Na2O2,两种化合物中阴、阳离子的个数比均为1:2,故A错误;
B.Y是O元素,R是S元素,水中含有氢键,沸点高,即Y的氢化物熔沸点比R的氢化物高,故B错误;
C.非金属性:S>C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以最高价氧化物对应水化物的酸性强弱顺序:R>W>Z,故C正确;
D.Y是O元素,Z为Si元素、W为C元素、R为S元素,O与Si只能形成一种氧化物二氧化硅,故D错误.
故选C.
点评 本题考查原子结构和元素周期律的递变规律,题目难度中等,根据原子结构特点正确推断元素的种类为解答该题的关键,注意元素非金属性的比较.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
2.分子式为C7H12O4的酯,在酸性条件下水解生成一种二元有机酸X和一种醇Y,下列有关有机酸X和醇Y的结构数目正确的是( )
| 选项 | 有机酸X的数目 | 醇Y的数目 |
| A | 4种 | 3种 |
| B | 4种 | 2种 |
| C | 5种 | 3种 |
| D | 5种 | 2种 |
| A. | A | B. | B | C. | C | D. | D |
20.下列有关说法正确的是( )
| A. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 | |
| B. | 乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| D. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同 |
7.化学与人类生活密切相关,下列说法不正确的是( )
| A. | 化学可以识别、改变和创造分子 | |
| B. | 金刚石常用作砂纸、砂轮的磨料 | |
| C. | 氧化铁常用作红色油漆和涂料 | |
| D. | 葡萄糖可用于合成补钙药物及维生素C(结构如图) |
4.将3.2g铜与30mL10mol/L的硝酸充分反应,还原产物为NO2和NO,反应后溶液中含a mol H+,则此时溶液中所含NO3-的物质的量为( )
| A. | 0.1a mol | B. | (0.1+a)mol | C. | (0.05+a)mol | D. | 2a mol |
2.下列关于反应“化合物甲+单质A$\stackrel{一定条件}{→}$化合物乙+单质B”的说法正确的是( )
| A. | 反应在水溶液中进行时,若A为金属,则B一定是金属 | |
| B. | 反应在水溶液中进行时,若A为非金属,则B一定是非金属 | |
| C. | 反应在加热或高温下进行时,若A为金属,则B一定是非金属 | |
| D. | 反应在加热或高温下进行时,若A为非金属,则B一定是金属 |
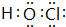
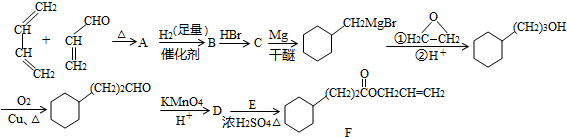
 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键. .
. .
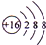
. ;(2)NaOH
;(2)NaOH ;(3)HClO
;(3)HClO ;(4)H2O2
;(4)H2O2 .
.