题目内容
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA |
| B、78 g苯含有C=C双键的数目为3 NA |
| C、1 L 1 mol?L-1的NaClO溶液中含有ClO-的数目为NA |
| D、标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、N2与CO摩尔质量相同都为28g/mol,都是双原子分子;
B、苯分子中的碳碳键是完全等同的一种特殊的化学键,
C、次氯酸根离子是弱酸阴离子,水溶液中发生水解;
D、依据标准状况下气体物质的量n=
mol,结合二氧化氮和水反应生成硝酸和一氧化氮的氧化还原反应计算电子转移;
B、苯分子中的碳碳键是完全等同的一种特殊的化学键,
C、次氯酸根离子是弱酸阴离子,水溶液中发生水解;
D、依据标准状况下气体物质的量n=
| V |
| 22.4 |
解答:
解:A、N2与CO摩尔质量相同都为28g/mol,都是双原子分子,14 g 由N2与CO组成的混合气体物质的量=
=0.5mol,含有的原子数目为NA,故A正确;
B、苯分子中的碳碳键是完全等同的一种特殊的化学键,不存在碳碳双键,故B错误;
C、次氯酸根离子是弱酸阴离子,水溶液中发生水解;1 L 1mol?L-1的NaClO溶液中含有ClO-的数目小于NA,故C错误;
D、标准状况下气体物质的量n=
=0.3mol,二氧化氮和水反应生成硝酸和一氧化氮的反应为3NO2+H2O=2HNO3+NO,氧化还原反应中0.3mol二氧化氮反应转移电子0.2mol;故D错误;
故选A.
| 14g |
| 28g/mol |
B、苯分子中的碳碳键是完全等同的一种特殊的化学键,不存在碳碳双键,故B错误;
C、次氯酸根离子是弱酸阴离子,水溶液中发生水解;1 L 1mol?L-1的NaClO溶液中含有ClO-的数目小于NA,故C错误;
D、标准状况下气体物质的量n=
| 6.72L |
| 22.4L/mol |
故选A.
点评:本题考查了阿伏伽德罗常数的应用,主要有盐类水解应用,苯分子结构的掌握,气体摩尔体积的计算应用,题目难度中等.

练习册系列答案
相关题目
下列晶体模型对应的物质熔化时破坏共价键的是( )
A、 金刚石模型 金刚石模型 |
B、 干冰模型 |
C、 碳60模型 |
D、 氯化钠模型 |
有关化学用语表达,下列正确的是( )
A、CS2的比例模型: |
B、铍原子最外层的电子云图: |
| C、石英的分子式:SiO2 |
D、氮原子最外层轨道表示式: |
取19.2g铜跟少量的浓硝酸反应,铜全部溶解后,收集到NO2、NO混合气体的体积11.2L(标准状况),反应消耗硝酸的物质的量是( )
| A、0.5mol |
| B、0.8mol |
| C、1.1mol |
| D、1.2mol |
下列说法正确的是( )
| A、SO3溶于水后能导电,故SO3为电解质 |
| B、强电解质的水溶液中不存在大量溶质分子 |
| C、向NaCN溶液中滴入酚酞试液显红色,则HCN为强酸 |
| D、25℃时,用CH3COOH溶液滴定等浓度NaOH溶液至pH=7,V(CH3COOH)<V(NaOH) |
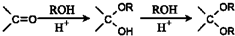
 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).