题目内容
下列晶体模型对应的物质熔化时破坏共价键的是( )
A、 金刚石模型 金刚石模型 |
B、 干冰模型 |
C、 碳60模型 |
D、 氯化钠模型 |
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:晶体模型对应的物质熔化时破坏共价键说明该晶体属于原子晶体,原子晶体是由原子之间通过共价键形成的,据此分析解答.
解答:
解:晶体模型对应的物质熔化时破坏共价键说明该晶体属于原子晶体,
A.金刚石是由C原子构成的,属于原子晶体,故A正确;
B.干冰是由二氧化碳分子构成的,属于分子晶体,故B错误;
C.C60是由分子构成的,属于分子晶体,故C错误;
D.NaCl是由氯离子和钠离子构成的,属于离子晶体,故D错误;
故选A.
A.金刚石是由C原子构成的,属于原子晶体,故A正确;
B.干冰是由二氧化碳分子构成的,属于分子晶体,故B错误;
C.C60是由分子构成的,属于分子晶体,故C错误;
D.NaCl是由氯离子和钠离子构成的,属于离子晶体,故D错误;
故选A.
点评:本题考查晶体类型的判断,侧重考查基本理论,明确晶体的构成微粒即可解答,熟练掌握常见晶体的类型及构成微粒,题目难度不大.

练习册系列答案
相关题目
下列各组中的离子,能在溶液中大量共存的是( )
| A、Cu2+、Ba2+、C1-、SO42- |
| B、K+、Na+、OH-、C1- |
| C、Na+、H+、SO42-、OH- |
| D、H+、Na+、Cl-、CO32- |
炼铁的总反应为 Fe2O3(s)+3CO(g)→2Fe(s)+3CO2(g)+Q kJ,可能发生了以下过程:
3Fe2O3(s)+CO(g)→2Fe3O4(s)+CO2(g)+Q1 kJ;
Fe3O4(s)+CO(g)→3FeO(s)+CO2(g)+Q2 kJ;
FeO(s)+CO(g)→Fe(s)+CO2(g)+Q3 kJ.
则Q与Q1、Q2、Q2的关系式正确的是( )
3Fe2O3(s)+CO(g)→2Fe3O4(s)+CO2(g)+Q1 kJ;
Fe3O4(s)+CO(g)→3FeO(s)+CO2(g)+Q2 kJ;
FeO(s)+CO(g)→Fe(s)+CO2(g)+Q3 kJ.
则Q与Q1、Q2、Q2的关系式正确的是( )
| A、Q=Q1+Q2+Q3 | ||
| B、Q=Q1-Q2-Q3 | ||
C、Q=
| ||
D、Q=
|
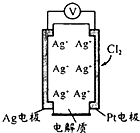 利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质.下列分析不正确的是( )
| A、电子经外电路流向Pt电极 |
| B、电池工作时,电解质中Ag+数目减少 |
| C、正极反应:C12+2e-+2Ag+=2AgCl |
| D、空气中c(C12)越大,Ag极消耗速率越快 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA |
| B、78 g苯含有C=C双键的数目为3 NA |
| C、1 L 1 mol?L-1的NaClO溶液中含有ClO-的数目为NA |
| D、标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA |
 现有 D、E、F六种物质,其中A、B、C是由短周期元素组成的常见单质,D分子含有10个电子,F是一种不含金属元素的盐.一定条件下转化关系如下:请回答:
现有 D、E、F六种物质,其中A、B、C是由短周期元素组成的常见单质,D分子含有10个电子,F是一种不含金属元素的盐.一定条件下转化关系如下:请回答: