题目内容
下列说法正确的是( )
| A、SO3溶于水后能导电,故SO3为电解质 |
| B、强电解质的水溶液中不存在大量溶质分子 |
| C、向NaCN溶液中滴入酚酞试液显红色,则HCN为强酸 |
| D、25℃时,用CH3COOH溶液滴定等浓度NaOH溶液至pH=7,V(CH3COOH)<V(NaOH) |
考点:电解质与非电解质,强电解质和弱电解质的概念
专题:电离平衡与溶液的pH专题
分析:电解质:水溶液中或熔融状态下能够导电的化合物;强电解质是完全电离的化合物,强碱弱酸盐在溶液中存在水解,导致溶液呈碱性;
A、三氧化硫本身不能电离;
B、强电解质完全电离,溶液中不存在电解质分子;
C、氰化钠属于强碱弱酸盐,存在水解;
D、pH=7,溶液呈中性,据此分析即可.
A、三氧化硫本身不能电离;
B、强电解质完全电离,溶液中不存在电解质分子;
C、氰化钠属于强碱弱酸盐,存在水解;
D、pH=7,溶液呈中性,据此分析即可.
解答:
解:A、三氧化硫和水反应生成硫酸,硫酸能电离出自由移动的阴阳离子,所以三氧化硫的水溶液导电,但电离出离子的物质是硫酸不是三氧化硫,所以三氧化硫是非电解质,故A错误;
B、强电解质在溶液中完全电离出离子,溶液中不存在电解质分子,故B正确;
C、向NaCN溶液中滴入酚酞试液显红色,即CN-水解导致溶液呈碱性,故HCN为弱酸,故C错误;
D、弱酸在水溶液中部分电离,醋酸与氢氧化钠等物质的量浓度混合,溶液呈中性,则醋酸溶液体积大于氢氧化钠,故D错误;
故选B.
B、强电解质在溶液中完全电离出离子,溶液中不存在电解质分子,故B正确;
C、向NaCN溶液中滴入酚酞试液显红色,即CN-水解导致溶液呈碱性,故HCN为弱酸,故C错误;
D、弱酸在水溶液中部分电离,醋酸与氢氧化钠等物质的量浓度混合,溶液呈中性,则醋酸溶液体积大于氢氧化钠,故D错误;
故选B.
点评:本题考查了电解质的概念,抓住电解质的特征是解题的关键,难度不大,水解的盐类导致水的电离受到破坏.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案
相关题目
下列各组中的离子,能在溶液中大量共存的是( )
| A、Cu2+、Ba2+、C1-、SO42- |
| B、K+、Na+、OH-、C1- |
| C、Na+、H+、SO42-、OH- |
| D、H+、Na+、Cl-、CO32- |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA |
| B、78 g苯含有C=C双键的数目为3 NA |
| C、1 L 1 mol?L-1的NaClO溶液中含有ClO-的数目为NA |
| D、标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA |
0.2L 1mol/LFeCl3与0.3L 1mol/LMgCl2两溶液中,Cl-的物质的量浓度之比为( )
| A、3:2 | B、1:1 |
| C、2:3 | D、1:3 |
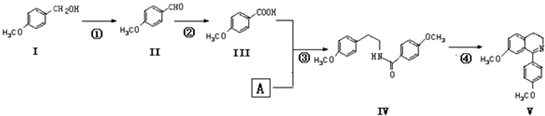
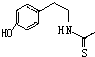 )在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为
)在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为