题目内容
3.NA表示阿伏加德罗常数的值,下列说法正确的有几个( )①在常温常压下,1mol氦气含有原子数为2NA
②0.5molO2和0.5molO3的混合物所含有的氧原子个数为2.5NA
③常温常压下,18gH2O中含有的质子数为10NA
④常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
⑤1molNa2O2与足量水完全反应,转移电子数为NA
⑥1molNaHCO3受热分解产生CO2分子数为0.5NA
⑦1mol/L NaCl溶液含有NA个Na+
⑧13.5g Al与足量氢氧化钠溶液反应生成H2的分子数为NA
⑨标准状况下,2.24LCH4所含电子数为NA.
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
分析 ①氦气为单原子分子;
②0.5molO2中含1mol氧原子;0.5molO3中含1.5mol氧原子;
③求出18gH2O的物质的量,然后根据水中含10个质子来分析;
④常温常压下,气体摩尔体积大于22.4L/mol;
⑤Na2O2与水的反应为歧化反应;
⑥NaHCO3受热分解反应为:2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2;
⑦NaCl溶液体积不明确;
⑧求出13.5g Al的物质的量,然后根据2mol铝~3mol氢气来分析;
⑨标准状况下,2.24LCH4的物质的量为1mol,然后根据甲烷中含10个电子来分析.
解答 解:①氦气为单原子分子,故1mol氦气中含NA个氦原子,故错误;
②0.5molO2中含1mol氧原子;0.5molO3中含1.5mol氧原子,故两者的混合物中含2.5mol氧原子即2.5NA个,故正确;
③18gH2O的物质的量为1mol,而水中含10个质子,故1mol水中含10NA个质子,故正确;
④常温常压下,气体摩尔体积大于22.4L/mol,故2.24LCO和CO2混合气体的物质的量小于0.1mol,则含有的碳原子数小于0.1NA个,故错误;
⑤Na2O2与水的反应为歧化反应,故1mol过氧化钠转移NA个电子,故正确;
⑥NaHCO3受热分解反应为:2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2,故1molNaHCO3受热分解生成0.5mol二氧化碳即0.5NA个二氧化碳分子,故正确;
⑦NaCl溶液体积不明确,故溶液中的钠离子的个数无法计算,故错误;
⑧13.5g Al的物质的量为n=$\frac{13.5g}{27g/mol}$=0.5mol,而2mol铝~3mol氢气,故0.5mol铝生成0.75mol氢气即0.75NA个,故错误;
⑨标准状况下,2.24LCH4的物质的量为0.1mol,故甲烷中含10个电子,故0.1mol甲烷中含NA个电子,故正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | 阴极区 | B. | 阳极区 | C. | 中间区 | D. | 水区均得到 |
| A. | Cu2+、Cl-、Mg2+、NO3- | B. | K+、Cl-、Mg2+、SO42- | ||
| C. | Fe3+、Na+、NO3-、Al3+ | D. | HCO3-、NH4+、Ag+、NO3- |

(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)CO与O2设计成燃料电池(以KOH溶液为电解液).该电池的负极反应式为CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
①该反应的△H小于0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>、=或<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、3a mol H2、 b mol CH3OH(g)、b mol H2O(g) |
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2,在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为Ⅱ>Ⅲ>Ⅰ(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图3.
①当温度在300℃~400℃范围时,温度是乙酸生成速率的主要影响因素;
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
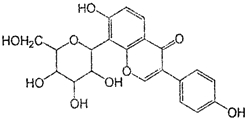
| A. | 该物质在一定条件下能发生消去反应、加成反应、取代反应 | |
| B. | 葛根素的分子式为C21H22O9 | |
| C. | 该物质在一定条件下能与碳酸氢钠溶液反应 | |
| D. | 一定条件下1 mol 该物质与H2反应最多能消耗7 mol H2 |
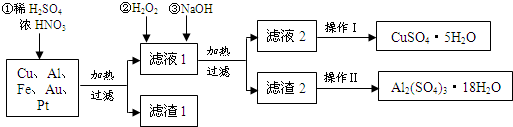

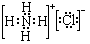 ;②B溶于水的过程中存在的可逆反应式为NH3+H2O
;②B溶于水的过程中存在的可逆反应式为NH3+H2O  NH3•H2O
NH3•H2O  NH4++OH-.
NH4++OH-. .固体甲溶于水后,溶液呈碱(酸、碱或中性),写出甲与水反应的化学方程式NH5+H2O=NH3•H2O+H2↑.
.固体甲溶于水后,溶液呈碱(酸、碱或中性),写出甲与水反应的化学方程式NH5+H2O=NH3•H2O+H2↑.