题目内容
13.某化学兴趣探究小组将一批废弃的线路板简单处理后,得到含Cu(70%)、Al(25%)、Fe(4%)及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: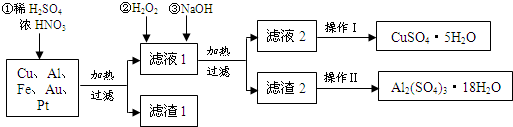
(1)在金属混合物与酸的反应中,表现氧化性的离子为NO3-;得到滤渣1的主要成分为Au、Pt.
(2)第②步加H2O2后发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
通过加入NaOH调节溶液的pH,其目的是使Al3+、Fe3+转化为沉淀;
(3)通过操作Ⅱ可以由滤渣2制取Al2(SO4)3•18H2O.下列是操作Ⅱ的一种实验方案.

实验中:试剂1是H2SO4,试剂2是Al.(填化学式)
分析 Cu、Fe、Al、Au的混合物中加入硫酸和浓硝酸的混合物溶解,可以得到滤液1为铁盐、铝盐、铜盐溶液,滤渣1为Au、Pt,向滤液1中加入双氧水和氢氧化钠,加H2O2的作用是把Fe2+氧化为Fe3+,结合沉淀的pH可知,调节pH为<4,过滤分离出氢氧化铁,再调节pH为5左右,过滤得滤液2为硫酸铜溶液,滤渣2为Al(OH)3,加硫酸溶解后结晶得到晶体,
(1)在金属混合物与酸的反应中,硝酸充当氧化剂,根据上面的分析可知滤渣1的成份;
(2)过氧化氢具有氧化性且被还原为水,无杂质无污染;可以氧化亚铁离子为铁离子易于沉淀除去,调节溶液PH目的是铁离子和铝离子全部沉淀;第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染.调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,滤渣2的成分为氢氧化铁和氢氧化铝;
(3)滤渣2含有氢氧化铁、氢氧化铝,加入硫酸后再加入铝可除杂铁,蒸发结晶可得到硫酸铝晶体.
解答 解:Cu、Fe、Al、Au的混合物中加入硫酸和浓硝酸的混合物溶解,可以得到滤液1为铁盐、铝盐、铜盐溶液,滤渣1为Au、Pt,向滤液1中加入双氧水和氢氧化钠,加H2O2的作用是把Fe2+氧化为Fe3+,结合沉淀的pH可知,调节pH为<4,过滤分离出氢氧化铁,再调节pH为5左右,过滤得滤液2为硫酸铜溶液,滤渣2为Al(OH)3,加硫酸溶解后结晶得到晶体,
(1)在金属混合物与酸的反应中,硝酸充当氧化剂,根据上面的分析可知滤渣1为Au、Pt,故答案为:NO3-;Au、Pt;
(2)第②步加H2O2是为了将Fe2+氧化为Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,滤液1为铁盐、铝盐溶液,加入过量NaOH溶液,调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;使Al3+、Fe3+转化为沉淀;
(3)先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体,
故答案为:H2SO4;Al.
点评 本题考查物质的制备实验,为高频考点,把握制备实验流程及物质组成、性质、发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度中等.

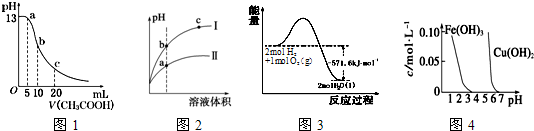
| A. | 图l表示常温下向体积为10mL0.1mol•L-1NaOH溶液中逐滴加入O.1mol•L-1CH3COOH液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) | |
| B. | 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中I表示醋酸,II表示盐酸,且溶液导电性:c>b>a | |
| C. | 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8kJ.mol-1 | |
| D. | 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶掖中加入适量CuO,调节溶液的pH至4 |
| A. | 浓度均为0.1mol/L的①CH3COOH ②NH4Cl ③H2SO4三种溶液中,由水电离出的c(H+):①>③>② | |
| B. | 常温下,pH=2与pH=3的CH3COOH溶液,前者的c(CH3COOH)是后者的10倍 | |
| C. | 任意稀盐酸中c(H+)的精确计算式可以表示为c(H+)=c(Cl-)+Kw/c(OH-) | |
| D. | 同c(NH4+)的溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4溶液,物质的量浓度最大的是③ |
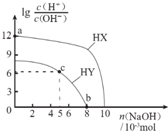 常温下,浓度均为0.1mol?L-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )
常温下,浓度均为0.1mol?L-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )| A. | HX的酸性弱于HY | |
| B. | a点由水电离出的c(H+)=10-12 mol?L-1 | |
| C. | c点溶液中:c(Y-)>c(HY) | |
| D. | b点时酸碱恰好完全反应 |
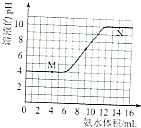 常温下,用一定浓度的氨水滴定一定体积未知浓度的土壤浸出溶液,溶液的pH变化与滴入氨水体积的关系如图所示,下列有关说法不正确的是( )
常温下,用一定浓度的氨水滴定一定体积未知浓度的土壤浸出溶液,溶液的pH变化与滴入氨水体积的关系如图所示,下列有关说法不正确的是( )| A. | 该土壤是酸性土壤 | |
| B. | 当溶液中c(H+)=c(OH-)时,消耗氨水的体积为9mL | |
| C. | M、N点由水电离出的氢离子浓度一定相等 | |
| D. | 将20mL此氨水与10mL同浓度的盐酸混合,充分反应后存在:C(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+) |
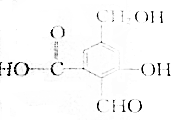 .
.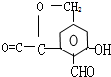 .
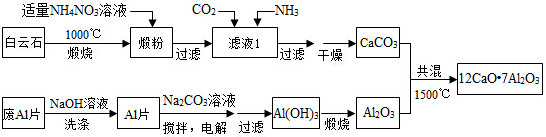
.
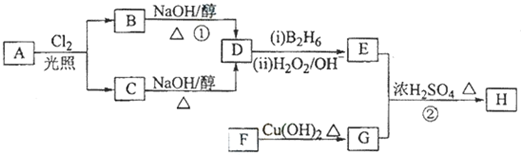
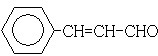 ;
;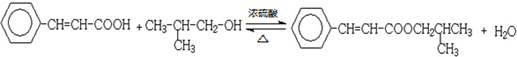 .
.