题目内容
11.利用电渗析法淡化海水时,得到淡水的部分( )| A. | 阴极区 | B. | 阳极区 | C. | 中间区 | D. | 水区均得到 |
分析 电渗析法淡化海水时,如图 ,阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜B和阴极相连,阴极是阳离子放电,所以隔膜B是阳离子交换膜,以此来解答.
,阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜B和阴极相连,阴极是阳离子放电,所以隔膜B是阳离子交换膜,以此来解答.
解答 解:电渗析法淡化海水时,如图 ,阴离子从隔膜B移向阴极,阳离子从隔膜A移向阳极,得到淡水的部分为中间区,
,阴离子从隔膜B移向阴极,阳离子从隔膜A移向阳极,得到淡水的部分为中间区,
故选C.
点评 本题考查海水资源的应用,为高频考点,把握电渗析法淡化海水原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
1.根据下列各图曲线表征的信息,得出的结论不正确的是( )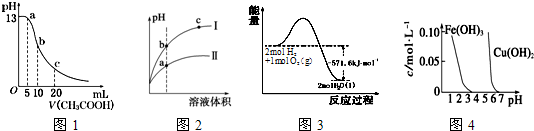

| A. | 图l表示常温下向体积为10mL0.1mol•L-1NaOH溶液中逐滴加入O.1mol•L-1CH3COOH液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) | |
| B. | 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中I表示醋酸,II表示盐酸,且溶液导电性:c>b>a | |
| C. | 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8kJ.mol-1 | |
| D. | 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶掖中加入适量CuO,调节溶液的pH至4 |
19.下列各组物质,不用任何试剂即可鉴别开来的是( )
| A. | NaCl、NaBr、KI三种无色溶液 | |
| B. | HCl、NaCl、NaNO3、Na2CO3四种溶液 | |
| C. | NaBr、KCl、HCl三种溶液 | |
| D. | 淀粉、淀粉碘化钾、KI、溴水四种溶液 |
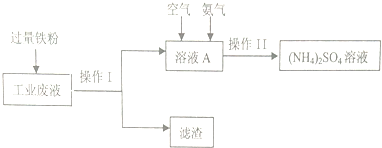
20.萜类物质中有许多都已被用于香料工业,常见的有如下图几种结构.下列有关说法正确的是( )
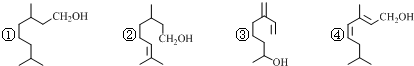
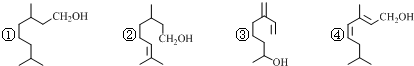
| A. | ①③④互为同分异构体 | |
| B. | ②③④互为同系物 | |
| C. | 上述四种物质中能使酸性KMnO4溶液褪色的只有②③④ | |
| D. | 上述物质分别与足量H2发生加成反应,共可得2种产物 |
1.(Ⅰ)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图1:

在阳极区发生的反应包括4OH--4e-═2H2O+O2↑和H++HCO3-═H2O+CO2↑.用平衡原理简述CO32-在阴极区再生的过程HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电,浓度减小平衡右移.
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇.
已知:25℃,101KPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50kJ/mol.
(3)在密闭的再生装置中,加入5mol H2与2mol CO2发生反应生成甲醇,反应达到平衡
时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图2所示,下列说法正确的是A C D
A.P1>P2>P3>P4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.图示中,该反应的温度变化为:T1>T2>T3>T4
D.T4、P4、时,H2的平衡转化率为60%
(Ⅱ)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
①CH4和NO2反应正反应为放热反应(填“放热”或“吸热”);
②T1℃时,反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)平衡常数K=6.4.
③温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减少(填“增大”、“减小”或“不变”).
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图1:

在阳极区发生的反应包括4OH--4e-═2H2O+O2↑和H++HCO3-═H2O+CO2↑.用平衡原理简述CO32-在阴极区再生的过程HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电,浓度减小平衡右移.
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇.
已知:25℃,101KPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50kJ/mol.
(3)在密闭的再生装置中,加入5mol H2与2mol CO2发生反应生成甲醇,反应达到平衡
时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图2所示,下列说法正确的是A C D
A.P1>P2>P3>P4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.图示中,该反应的温度变化为:T1>T2>T3>T4
D.T4、P4、时,H2的平衡转化率为60%
(Ⅱ)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
| 时间/min 温度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | 0.5 | 0.5 |
②T1℃时,反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)平衡常数K=6.4.
③温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减少(填“增大”、“减小”或“不变”).
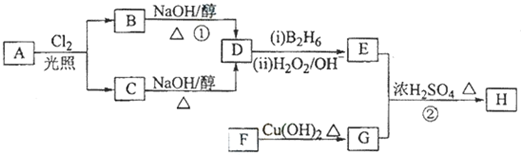
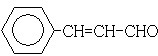 ;
;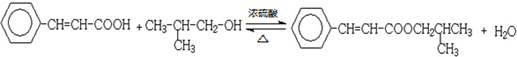 .
.